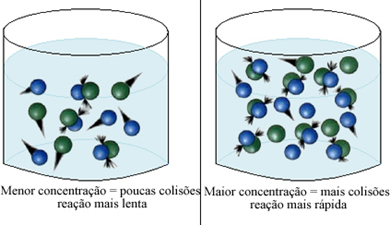
Podemos notar que siempre que aumentamos la concentración de uno o todos los reactivos que participan en una reacción química, aumenta su velocidad de desarrollo, es decir, la velocidad de la reacción.
Lo opuesto también es cierto. Por ejemplo, actualmente se recomienda que usemos gel de alcohol en lugar del alcohol regular, ya que hay menos riesgo de que se queme y así evitar accidentes. El alcohol líquido ordinario es en realidad una mezcla de alcohol y agua, y el alcohol en gel contiene una cantidad menor de alcohol. Por tanto, cuando se reduce la concentración de uno de los reactivos de combustión, en el caso del alcohol, la reacción avanza más lentamente. Por otro lado, cuanto más puro es el alcohol, más rápida es la reacción de combustión.

Como se indica en el texto Condiciones para la aparición de reacciones químicas, una de las condiciones para que se produzca una reacción es la colisión efectiva entre las partículas. Así, el aumento de la concentración de reactivos permite tener una mayor cantidad de partículas o moléculas confinadas en un mismo espacio. Esto aumenta la cantidad de colisiones entre ellos y también aumenta la probabilidad de que ocurran colisiones efectivas que resulten en la reacción. El resultado es que la reacción se produce más rápidamente.
Para ver esto, piense en el siguiente ejemplo: cuando tenemos una brasa encendida y queremos que esta combustión se procese más rápido, ¿soplamos o ventilamos la brasa? ¿Por qué funciona esto?
Bueno, uno de los reactivos de esta reacción de combustión es el oxígeno del aire. Cuando agitamos, la corriente de aire elimina la ceniza que se va formando durante la combustión y esto facilita el contacto del oxígeno con la brasa. De esta forma aumentamos el contacto entre los reactivos y aceleramos la reacción de combustión.
Brevemente, tenemos:

Cuando se trabaja con gases, una forma de aumentar la concentración de reactivos es bajar la presión. Cuando hacemos esto, disminuimos el volumen y, en consecuencia, hay un aumento en las concentraciones de reactivo.

Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm