LA solubilidad, o coeficiente de solubilidad, es una propiedad física de la materia que siempre está prácticamente determinada en el laboratorio. Está relacionado con la capacidad que tiene un material, llamado sustancia disoluta, se presenta para ser disuelto por otro, el solvente.
En cuanto a la solubilidad, los solutos se pueden clasificar de la siguiente manera:
Solubles: los que se disuelven en el solvente. El cloruro de sodio (soluto), por ejemplo, es soluble en agua (disolvente);
Ligeramente soluble: aquellos que tienen dificultad para disolverse en el solvente. Este es el caso del hidróxido de calcio [Ca (OH)2] (soluto) en agua;
Insolubles: ésos no se disuelven en el solvente. La arena (soluto), por ejemplo, es insoluble en agua.
LA solubilidad está muy asociado con la preparación de soluciones (mezclas homogéneas), ya que para obtener una solución es fundamental que el soluto utilizado sea soluble en el disolvente.
Factores que influyen en la solubilidad
Incluso cuando el soluto es soluble en el solvente, existen algunos factores que pueden influir en la capacidad del soluto para disolverse. Son ellos:
a) Relación entre la cantidad de soluto y solvente
El solvente siempre tiene un límite de soluto que puede disolver. Si aumentamos la cantidad de disolvente manteniendo la cantidad de soluto, el disolvente tiende a disolver todo el soluto utilizado.
B) Temperatura
La temperatura es el único factor físico capaz de modificar la solubilidad de un solvente con respecto a un soluto dado. Esta modificación depende de la naturaleza del soluto, como veremos a continuación:
soluto endotérmico: es el que logramos disolver una masa mayor, siempre y cuando el solvente esté a una temperatura superior a la temperatura ambiente. Cuanto más caliente esté el disolvente, más soluto se disolverá.
Ejemplo: Es posible disolver una mayor cantidad de café molido cuando el agua está caliente.
Soluto exotérmico: es el que logramos disolver una masa mayor, siempre y cuando el solvente esté a una temperatura inferior a la temperatura ambiente. Cuanto más frío esté el disolvente, más soluto se disolverá.
Ejemplo: Es posible disolver una mayor cantidad de dióxido de carbono cuando el refresco está frío.
Formas de determinar la solubilidad
Como la solubilidad es una propiedad determinada de forma experimental, los materiales, en general, ya han tenido sus solubilidades evaluadas en los más diferentes disolventes. Así, podemos acceder a la solubilidad de un soluto en un determinado solvente de la siguiente manera:
a) Análisis de una tabla
A menudo, el estudiante puede encontrar solubilidad a partir de la interpretación de una tabla. Vea el siguiente ejemplo:
Ejemplo: (UEPG - adaptado) La siguiente tabla muestra la solubilidad de la sal de Li2CO3 en 100 gramos de agua.

La tabla presenta los valores de masa en gramos de Li2CO3 que se puede disolver en 100 gramos de agua, desde 0 OC hasta 50 OC. Podemos ver que cuanto más caliente está el agua, menos Li2CO3 se disuelve. Por lo tanto, Li2CO3 es un soluto exotérmico (se disolverá más si el agua está fría).
b) Análisis de una gráfica
La solubilidad se puede evaluar interpretando un gráfico. Para hacer esto, simplemente determine la temperatura, gírela hacia la curva y luego gire la curva hacia el eje y, que es la masa en gramos de soluto que se disolverá.
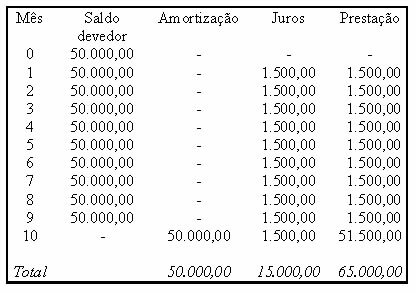
Ejemplo: (UFTM - adaptado) El gráfico muestra la curva de solubilidad de una sal AX2.
La gráfica dice que, en el eje y, la cantidad de agua (solvente) es 100 gramos. Para soluto AX2, determinaremos la cantidad de agua a las siguientes temperaturas:
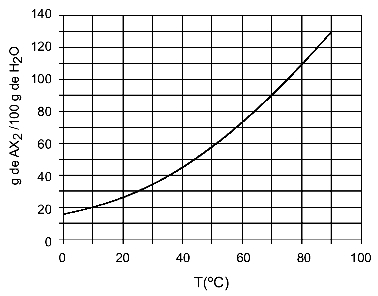
30OC: Cuando encendemos la temperatura 30OC a la curva y luego la curva al eje y, tenemos que, a esta temperatura, los 100 gramos de agua pueden disolver aproximadamente 35 gramos de soluto AX2.
Determinación de la solubilidad de AX2 a los 30OC
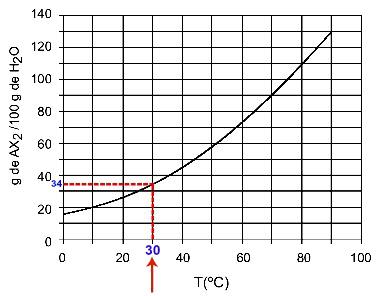
40OC: Cuando encendemos la temperatura 40OC a la curva y luego la curva al eje y, tenemos que, a esta temperatura, los 100 gramos de agua pueden disolver aproximadamente 45 gramos de soluto AX2.
Determinación de la solubilidad de AX2 a los 40OC
Como la cantidad disuelta de soluto es mayor con cada aumento de temperatura, tenemos que el AX2 es un soluto endotérmico.
c) interpretación textual
Vea el siguiente ejemplo:
Ejemplo: (PUC-MG) Ciertas sustancias son capaces de formar mezclas homogéneas con otras sustancias. La sustancia que está en mayor cantidad se llama solvente y la que está en menor cantidad se llama soluto. El cloruro de sodio (NaCl) forma una solución homogénea con agua, en la que es posible solubilizar, a 20ºC, 36 g de NaCl en 100 g de agua.
El texto dice que si tenemos 100 gramos de agua (solvente), a una temperatura de 20 OC, es posible disolver hasta 36 gramos de NaCl.
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm