En la vida cotidiana y en los laboratorios hay reacciones y transformaciones espontáneas y otras no espontáneas. Por ejemplo, toda combustión es una reacción espontánea, porque una vez iniciada, continuará hasta que se consuma todo el combustible o hasta que se acabe todo el oxígeno.
Por otro lado, la electrólisis es un proceso no espontáneo, en el que la energía eléctrica se transforma en energía química. Un ejemplo es la electrólisis de cloruro de sodio (NaCl). Cuando se pasa una corriente eléctrica sobre esta sal fundida, se producen reacciones redox y la formación de sodio metálico (Na(s)) y cloro gaseoso (Cl2 (g)). Si dejamos de ejecutar la corriente eléctrica, la reacción no continuará por sí sola, lo que demuestra que no es espontánea.
La espontaneidad de una reacción se puede medir utilizando el Ecuación de Gibbs-Helmholtz, dada a continuación:

En que:
∆G = variación de la energía libre;
∆H = cambio de entalpía;
T = temperatura en Kelvin (siempre positivo);
∆S = cambio de entropía.
Esta ecuación toma su nombre porque fue propuesta por el físico estadounidense J. Willard Gibbs (1839-1903) y por el físico alemán Hermann Helmholtz (1821-1894).
Para comprender mejor cómo esta ecuación nos ayuda a determinar la espontaneidad de una reacción, repasemos brevemente cada uno de los conceptos involucrados en ella:
- ∆H (variación de entalpía): La entalpía (H) es el contenido energético de una sustancia. Hasta el momento, no se conoce ninguna forma de determinarlo. En la práctica, lo que se consigue es medir la variación de entalpía (∆H) de un proceso, utilizando calorímetros. Esta variación es la cantidad de energía que fue liberada o absorbida en el proceso.
- ∆S (variación de entropía):La entropía (S) es la cantidad termodinámica que mide el grado de desorden en un sistema.
Por ejemplo, al derretir hielo, las moléculas se mueven de un estado sólido a uno líquido, donde hay una mayor desorganización. Esto significa que en este proceso la entropía aumentó (∆S> 0).
En la producción de amoniaco (NH3), 1 mol de nitrógeno gaseoso reacciona con 3 mol de hidrógeno gaseoso (es decir, 4 mol de moléculas en los reactivos), dando lugar a 2 mol de amoníaco:
norte2 (g) +3 H2 (g) → 2 NH3 (g)
Dado que el número de moléculas en la fase gaseosa disminuye en este proceso, la desorganización disminuyó, lo que significa que la entropía también disminuyó (∆S <0).
- ∆G (Energía libre): Energía libre o Energía libre de Gibbs (porque fue propuesto solo por este científico en 1878) es la energía útil del sistema que se utiliza para realizar el trabajo.
Un sistema tiene energía global, pero solo una fracción de esa energía se utilizará para hacer trabajo, esto se llama energía libre de Gibbs, simbolizada por GRAMO.
Según Gibbs, un proceso se considera espontáneo si realiza un trabajo, es decir, si G disminuye. En este caso, el estado final de la transformación será más estable que el inicial cuando ∆G <0.
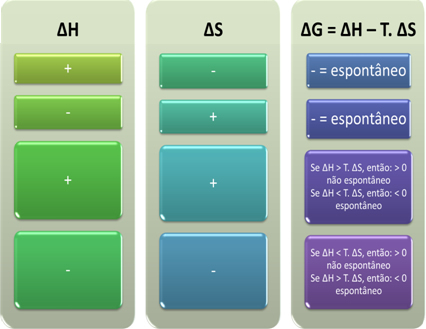
Con base en esto, podemos concluir lo siguiente:

También podemos ver si un proceso será espontáneo al observar el signo algebraico de ∆H y ∆S en la ecuación de Gibbs-Helmholtz:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
