En 1786, el anatomista italiano Luigi Galvani (1737-1798) diseccionó una rana en su mesa, en la que había una máquina electrostática. Galvani observó cómo los músculos del animal se contraían cuando su asistente tocó accidentalmente con la punta de su bisturí el nervio interno del muslo de la rana. En otras palabras, esto sucedió cuando los tejidos de la rana fueron tocados por dos metales diferentes.
Galvani empezó a defender, a partir de ese momento, una teoría que intentaba explicar este hecho: la teoría de la “electricidad animal”. Según Galvani, los metales eran solo conductores de electricidad, que en realidad estaría contenida en los músculos de la rana.
Sin embargo, su teoría estaba equivocada y así lo vio el físico italiano Alessandro Volta (1745-1827), quien llevó a cabo varios experimentos y notó que cuando la placa y el alambre eran del mismo metal, las convulsiones no aparecían, mostrando que no había flujo de electricidad. Así, pasó a defender el concepto (correcto) de que la electricidad no se origina en los músculos de la rana, sino en los metales y que los tejidos del animal conducen esta electricidad.
Para demostrar que tenía razón, Volta hizo un circuito formado por una solución electrolítica, es decir, una solución con iones. disuelto, al que llamó conductor húmedo o conductor de segunda clase, puesto en contacto con dos electrodos metálico. Estos últimos, Alessandro Volta los llamó conductores secos o conductores de primera clase.
Lo hizo colocando un conductor húmedo (que era una solución salina acuosa) entre dos conductores secos (que eran metales conectados por un cable conductor). En ese momento observó que el flujo eléctrico se estaba despertando. También llegó a comprender que, dependiendo de los metales que usaba, el flujo de corriente podría ser mayor o menor. Así, podemos admitir que la idea de lo que es una pila ya la estaba entendiendo y explicando Volta.
En 1800 Volta creó la primera celda eléctrica, que pasó a llamarse pila trasera, pila galvánica o celda voltaica y además, "rosario". A continuación se muestra un esquema de esta pila: colocó un disco de cobre sobre un disco de fieltro empapado en una solución de ácido sulfúrico, y finalmente un disco de zinc; y así sucesivamente, apilando estas series en una gran columna. El cobre, el fieltro y el zinc tenían un orificio en el medio y se enroscaban en una varilla horizontal, por lo que se conectaban mediante un cable conductor.
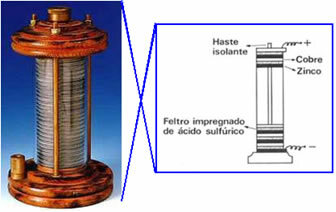
Este experimento provocó conmociones en el mundo científico y desde entonces en todos los dispositivos que producían electricidad a partir de procesos. Los productos químicos (es decir, que producían energía química en energía eléctrica) pasaron a llamarse células voltaicas, células galvánicas o, simplemente, baterías.
Volta hizo el mismo experimento con diferentes metales y soluciones de electrolitos, como discos de plata y zinc separados por discos de franela empapados en salmuera. Incluso realizó una demostración de este descubrimiento para Napoleón Bonaparte, como se ve en la figura siguiente, en la Academia de Ciencias de París.

Alessandro Volta demuestra su descubrimiento a Napoleón
Otro experimento de Volta con baterías fue el corona de anteojos, en el que colocó dos placas de diferentes metales interconectadas por un hilo conductor, pero separadas por soluciones de electrolitos.
Actualmente sabemos que lo que ocurre en una célula, como las que crea Volta, es que la electricidad fluye desde el polo. negativo, llamado ánodo, que se oxida, perdiendo electrones en el polo positivo, llamado cátodo, que reduce, ganando electrones.
Estas pilas fabricadas en solución acuosa no se utilizan mucho en la actualidad; solo en términos de investigación, pero fueron el principio que desarrolló las baterías modernas que conocemos hoy como baterías que son mucho más prácticos de usar y transportar, y proporcionan una corriente eléctrica satisfactoria para mucho más. hora.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/historia-das-pilhas.htm
