Cuando cocinamos alimentos en nuestros hogares, utilizamos la combustión de gas para cocinar. Una de las cosas que podemos ver en la llama resultante de la combustión de este gas es que su color es normalmente un azul muy claro. Sin embargo, en la mayoría de las reacciones de combustión, como encender una vela, la llama es amarilla.

Entonces surge la pregunta:
"Si cada incendio es el resultado de una reacción de combustión, ¿por qué algunas llamas tienen colores diferentes?"
Para entender cómo sucede esto, tenemos que entender qué es una reacción de combustión y qué sustancias están presentes en cada una de las reacciones mencionadas.
Una reacción de combustión ocurre cuando un combustible (material oxidable) es consumido por un oxidante (un material gaseoso que contiene oxígeno) para generar energía térmica (calor).
Otro punto importante que debemos saber sobre las reacciones de combustión es que pueden tener lugar en un completo o incompleto. Si hay suficiente oxígeno para consumir el combustible, la reacción se completará y producirá dióxido de carbono (CO
2) y agua (H2O). De lo contrario, la combustión será parcial, incompleta, generando monóxido de carbono (CO) y agua; o carbono (C) y agua.En ambos casos que estamos analizando, el oxidante es el oxígeno presente en el aire. Sin embargo, los combustibles son diferentes. El gas de cocción es en realidad gas licuado de petróleo (GLP), que es una mezcla de hidrocarburos (alcanos), siendo el combustible principal el butano (C4H10). Por lo tanto, el gas de cocción está formado por moléculas de alcanos que solo tienen tres o cuatro átomos de carbono, es por eso que se necesita poco oxígeno para que su combustión se produzca por completo. Esta reacción se puede expresar de la siguiente manera:
1C4H10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 horas2O(gramo), ∆H <0
En el caso de las velas, la parafina es el combustible de la reacción y está formada por una mezcla de alcanos con átomos de carbono que rango de 20 a 36. Con eso, se necesita mucho más oxígeno para que esta reacción se produzca por completo. Vea un ejemplo:
1C24H50 (s) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2O(gramo), ∆H <0
En el aire no hay suficiente oxígeno para llevar a cabo esta combustión completa, por lo que se produce de forma incompleta, como se muestra a continuación:
1C24H50 (s) +49/2 O2 (g) → 24 CO(gramo) + 25 H2O(gramo), ∆H <0
1C24H50 (s) +25/2 O2 (g) → 24C(s) + 25 H2O(gramo), ∆H <0
Las reacciones incompletas producen menos energía que la combustión completa. Esto explica la diferencia entre los colores de las llamas, ya que la llama amarilla, característica de la combustión incompleta, tiene menor energía. La llama azul es característica de una combustión completa, con mayor energía.
Esto también explica la formación de hollín por la llama de la vela (en la imagen de abajo), que se considera carbón como producto de una combustión incompleta.
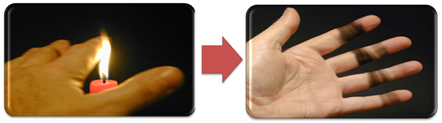
Pero, ¿por qué, en el mechero Bunsen, es posible tener llamas amarillas y azules cuando el combustible no cambia?
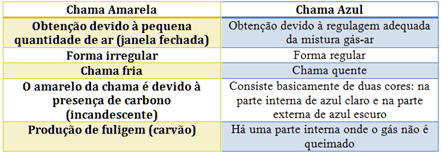
En el caso del mechero Bunsen, esto se consigue regulando la entrada de gas y aire. Si se cierra la ventana provocando la entrada de una pequeña cantidad de aire, la llama obtenida será amarilla, ya que tendrá poco oxígeno para realizar la combustión completa. Si la regulación de la mezcla gas-aire es adecuada, obtenemos una llama azul.
Vea las características de cada uno en la siguiente tabla:
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm

