Aprende a aplicar la primera ley de la termodinámica en diferentes situaciones, resuelve ejercicios y prueba tus conocimientos con ejercicios resueltos y explicados.
Pregunta 1
La primera ley de la termodinámica establece que:
a) La energía no se crea ni se destruye, pero se puede convertir de una forma a otra.
b) La energía siempre se conserva, pero no se puede convertir de una forma a otra.
c) La energía se puede crear o destruir, pero no se puede convertir de una forma a otra.
d) La energía no se puede conservar, pero se puede convertir de una forma a otra.
La primera ley de la termodinámica es el principio de conservación de la energía, por lo que en un sistema cerrado, la cantidad de energía permanece constante y solo puede transformarse de una forma a otra. otro.
Pregunta 2
Suponga un sistema cerrado que recibe 100 J de calor mientras realiza 50 J de trabajo. ¿Cuál es el cambio en la energía interna del sistema?
a) -50J
b) 0J
c) 50J
d) 100J
mi) 150J
Comprobación de las señales:
El calor recibido es Q positivo > 0.
El trabajo realizado es positivo W > 0.
De acuerdo con la primera ley, tenemos:
Pregunta 3
Un sistema de gas ideal intercambia 500 julios de calor con el ambiente externo. Suponiendo que este proceso es un enfriamiento isométrico, determine el trabajo y la energía interna, respectivamente.
a) 500 J y 0 J
b) - 500 y 0 J
c) 0 J y 500 J
d) 0 J y - 500 J
e) -500 J y 500 J
Dado que el proceso es isométrico, no hay cambio de volumen, por lo que el trabajo es cero.
Según la primera ley de la termodinámica:
Como es un enfriamiento, el sistema pierde calor, por lo tanto:
pregunta 4
8 moles de un gas ideal en un sistema pistón-cilindro se comprimen realizando 1000 J de trabajo. Durante el proceso, se pierden 400 J de calor hacia el ambiente externo. Su energía interna y el cambio en su temperatura son respectivamente iguales a
Dado: R = 8,31 J/mol. k
a) - 1400 J y variación aproximada de 6 K
b) 600 J y variación aproximada de 6 K
c) 600 J y variación aproximada de 14 K
d) - 1400 J y variación aproximada de 14 K
energía interna
Como el sistema recibe trabajo, su signo es negativo, al igual que el calor, que en este proceso se pierde.
La primera ley de la termodinámica es:
Sustituyendo los valores, obtenemos:
R = 8,31 J/mol·K
Temperatura
Por la ley de Joule tenemos:
pregunta 5
Un gas perfecto se comprime, realizando 500 J de trabajo. Al final de esta transformación, la energía interna del sistema cambió 200 J menos que al principio. La cantidad de calor intercambiado por el gas fue
a) - 700J
b) - 300J
do) 300J
d) 0J
e) 700J
Como se recibió el trabajo, es decir, trabajo resistente, su signo es negativo.
Sustituyendo los valores en la ecuación de la primera ley de la termodinámica:
pregunta 6
(CEDERJ 2021) En una etapa del ciclo que ejecuta un gas ideal en un acondicionador de aire, se aumenta la presión del gas manteniendo constante su volumen. En esta etapa del ciclo, el trabajo W realizado por el gas, la cantidad de calor Q absorbido por él y el cambio ΔT en su temperatura son, respectivamente:
a) W < 0, Q < 0 y ΔT < 0
b) W = 0, Q > 0 y ΔT > 0
c) W = 0, Q = 0 y ΔT = 0
d) W > 0, Q > 0 y ΔT > 0
Datos:
La presión P aumenta;
El volumen permanece constante;
Trabajar
Como el volumen es constante, el trabajo W es igual a cero.
La primera ley de la termodinámica dice así:
Como el calor es positivo, el cambio en la energía interna también será positivo.
Calor
Como el calor es absorbido, es positivo.
Temperatura
Por la ley de los gases:
Dónde,
n es el número de moles
R es la constante universal de los gases
Así, la temperatura depende únicamente de la presión, ya que el volumen es constante, siendo positivo.
pregunta 7
(UNICENTRO 2018) De acuerdo con la Primera Ley de la Termodinámica, el cambio en la energía interna de un sistema, ΔU, es dada por la diferencia entre el calor intercambiado con el ambiente exterior, Q, y el trabajo, W, realizado en el proceso termodinámica. Teniendo en cuenta esta información, si un gas monoatómico se expande para permanecer siempre a la misma temperatura, esta transformación se puede representar mediante la ecuación
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
El proceso isotérmico ocurre sin cambio de temperatura.
La energía está relacionada con la temperatura por:
Donde n es el número de moles y R es la constante universal de los gases. Como n y R son constantes, solo hay variación de temperatura, y
La primera ley de la termodinámica dice así:
pregunta 8
(URCA 2016) Según la primera ley de la termodinámica si, durante un proceso isotérmico que sufre un gas ideal de masa fija, el gas libera una cantidad de calor cuya magnitud es 50 cal entonces el cambio en la energía interna y el trabajo realizado por el gas en este proceso son, respectivamente:
a) 0 y 50 cal.
b) 50 cal y 0.
c) 0 y 0.
d) 50 cal y -50 cal.
e) 0 y -50 cal.
El cambio de energía interna está directamente relacionado con el cambio de temperatura. Como el proceso es isotérmico, no hay cambio de temperatura, por lo que .
De la primera ley de la termodinámica:
Como se libera calor, su signo es negativo.
pregunta 9
(UFRN 2012) La biomasa es una de las principales fuentes de energía renovable y, por lo tanto, las máquinas que la utilizan como combustible para la generación de energía son importantes desde el punto de vista ambiental. Un ejemplo muy común es el uso de biomasa para impulsar una turbina de vapor para generar trabajo. La figura del lado muestra esquemáticamente una central termoeléctrica simplificada.
En esta central termoeléctrica, la quema de biomasa en el horno produce calor, que calienta el agua de la caldera y genera vapor a alta presión. El vapor, a su vez, es conducido a través de tuberías hasta la turbina que, bajo su acción, comienza a girar sus álabes.
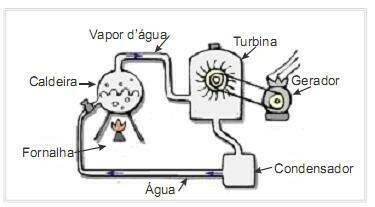
Suponga que las pérdidas de calor debidas a las diferencias de temperatura entre las partes de esta máquina térmica y el medio ambiente son insignificantes. En este contexto, la variación de la energía interna del agua de la caldera
a) es mayor que la suma del calor que se le suministra al quemar la biomasa y el trabajo realizado en la turbina.
b) es igual a la suma del calor que se le suministra al quemar la biomasa con el trabajo realizado en la turbina.
c) es igual a la diferencia entre el calor que se le suministra al quemar la biomasa y el trabajo realizado en la turbina.
d) es mayor que la diferencia entre el calor que se le suministra al quemar la biomasa y el trabajo realizado en la turbina.
El agua en la caldera recibe energía en forma de calor al quemar el combustible y libera energía en forma de trabajo realizado en la turbina.
pregunta 10
(UECE 2021) Respecto a las propiedades de los gases, prestar atención a las siguientes afirmaciones:
i. Para un gas ideal, la energía interna es función únicamente de la presión.
II. El calor absorbido por un gas al cambiar de estado es independiente del proceso.
tercero La energía interna de un gas ideal es función únicamente de la temperatura y es independiente del proceso.
IV. En una expansión isotérmica de un gas ideal, el trabajo realizado por éste es igual al calor absorbido.
Es correcto lo que se dice solo en
a) I y II.
b) III y IV.
c) I y IV.
d) II y III.
tercero CORRECTO. La energía interna de un gas ideal es función únicamente de la temperatura y es independiente del proceso.
El cambio de energía interna está directamente relacionado con el cambio de temperatura.
Donde n es el número de moles y R es la constante del gas ideal, siendo constantes, solo la temperatura determina la energía interna del gas.
IV. CORRECTO. En una expansión isotérmica de un gas ideal, el trabajo realizado por éste es igual al calor absorbido.
Como es isotérmico, no hay cambio de temperatura, por lo que el cambio de energía interna es cero. Por la primera ley de la termodinámica:
Obtenga más información con:
- Primera Ley de la Termodinámica
- Termodinámica: leyes, conceptos, fórmulas y ejercicios
- ejercicios de termodinamica
- ley de los gases
AST, Rafael. Ejercicios de la primera ley de la termodinámica.Todo importa, [Dakota del Norte.]. Disponible: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Acceso en:
vea también
- ejercicios de termodinamica
- Termodinámica
- transformación adiabática
- ejercicios de termoquimica
- Primera Ley de la Termodinámica
- Ciencias naturales y sus tecnologías: Enem
- Energía térmica
- Segunda Ley de la Termodinámica