LA oxidación y el reducción son reacciones que ocurren cuando hay un transferencia de electrones entre especies químicas. Son reacciones opuestas: en una oxidación hay pérdida de electrones y en una reducción hay ganancia de electrones.
Estos procesos ocurren simultáneamente, porque cuando una sustancia cede electrones a otra se oxida, mientras que la sustancia que recibe electrones se reduce.
Cuando una sustancia se oxida, hace que las otras especies se reduzcan, de ahí el nombre de agente reductor. Asimismo, una sustancia se reduce por la oxidación de otra y por lo tanto es el agente oxidante.
Las reacciones de oxidación y reducción se demuestran por la variación del número de oxidación (nox) de las especies involucradas.
Generalmente, una reacción que presenta oxidación y reducción puede ser representada por:
A + B+ → un+ + B
Dónde,
A: sustancia que se oxida, pierde electrones, aumenta su valor y es el agente reductor.
B: sustancia que sufre reducción, gana electrones, disminuye la oxidación y es el agente oxidante.
Ejemplos de oxidación y reducción.
Vea la siguiente imagen para ver un ejemplo de la ecuación química redox.
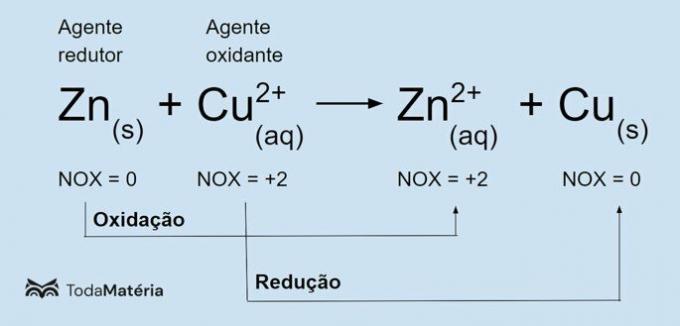
El zinc metálico sufre oxidación y provoca la reducción del cobre, por lo que es el agente reductor. Su número de oxidación (nox) aumenta de 0 a +2 porque pierde 2 electrones.
El ion cúprico (Cu2+) se reduce y hace que el cobre se oxide, por lo que es el agente oxidante. Su número de oxidación (nox) disminuye de +2 a 0 porque gana 2 electrones y se convierte en cobre metálico, que es eléctricamente neutro.
Otros ejemplos de reacciones redox en la vida cotidiana son:
combustión de metano
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosíntesis
6CO2(g) + 6H2O(v) → C6H12O6 (aquí) + 6O2(g)
corrosión del hierro
2Fe(s) + 3/4O2(g) + 3 horas2O(v) → 2Fe (OH)3 (óxido Fe2O3.3H2O)
Aprender más acerca de número de oxidación (nox).
¿Cómo se producen las reacciones de oxidación y reducción?
La ecuación de la reacción redox que involucra cobre y zinc se puede representar mediante semirreacciones, como se muestra a continuación.
- semirreacción de oxidación: zinc0(s) → 2e- + zinc2+(aquí)
- Semireacción de reducción: culo2+(aquí) + 2e- → culo0(s)
- ecuación global: zinc0(s) + culo2+(aquí) → zinc2+(aquí) + culo0(s)
Esta transferencia de electrones en la reacción redox ocurre de acuerdo con el potencial de reducción de las especies involucradas. El componente con menor potencial de reducción tiene tendencia a donar electrones, mientras que el de mayor potencial los recibirá.
Por ejemplo, el zinc tiene un potencial de reducción de -0,76 V, mientras que el cobre tiene un potencial de reducción de +0,34 V. Por lo tanto, el zinc, debido a que tiene un potencial de reducción más bajo, es un mejor agente reductor y promueve la reducción. el cobre, que tiene un mayor potencial de reducción y, por tanto, gana electrones y provoca la oxidación del zinc.
Lea también sobre reacciones redox.
Ejercicios de oxidación y reducción.
Use las siguientes preguntas para evaluar su conocimiento de lo que ha aprendido en este texto.
Pregunta 1
Con respecto a las reacciones de oxidación y reducción, es correcto afirmar que
a) El aumento del nox de la especie química indica que ha sufrido una reducción.
b) La sustancia que pierde electrones se oxida y es un agente oxidante.
c) En las reacciones redox se transfieren electrones.
d) La sustancia que gana electrones se reduce y es un agente reductor.
e) La disminución del nox de la especie química indica que ha sufrido oxidación.
Alternativa correcta: c) En las reacciones de oxidación-reducción se produce transferencia de electrones.
En las reacciones redox, se transfieren electrones.
La sustancia que gana electrones se reduce y es el agente oxidante. La disminución del nox de la especie química indica que se ha reducido.
La sustancia que pierde electrones se oxida y es un agente reductor. El aumento en el nox de la especie química indica que ha sufrido oxidación.
Pregunta 2
Ejemplos de reacciones redox en la vida cotidiana EXCEPTO
a) Corrosión
b) combustión
c) Fotosíntesis
d) Neutralización
Alternativa incorrecta: d) Neutralización.
Una reacción de neutralización es aquella que ocurre entre un ácido y una base, dando como resultado sal y agua. Por ejemplo:
NaOH + HCl → NaCl + H2O
Ejemplos de una reacción redox son:
combustión de metano
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotosíntesis
6CO2(g) + 6H2O(v) → C6H12O6 (aquí) + 6O2(g)
corrosión del hierro
2Fe(s) + 3/4O2(g) + 3 horas2O(v) → 2Fe (OH)3
Pregunta 3
Observa las siguientes reacciones de oxidación-reducción e indica cuáles son los agentes oxidantes y reductores.
YO. zinc0(s) + culo2+(aquí) → zinc2+(aquí) + culo0(s)
II. Culo2+(aquí) + H2(gramo) → 2H+(aquí) + culo(s)
tercero zinc(s) + 2H+(aquí) → zinc2+(aquí) + H2(g)
Respuesta:
En una reacción redox, el que se oxida es el agente reductor y el que se reduce es el agente oxidante.
YO. zinc0(s) + culo2+(aquí) → zinc2+(aquí) + culo0(s)
Agente oxidante: cobre (Cu)
Agente reductor: zinc (Zn)
II. Culo2+(aquí) + H2(gramo) → 2H+(aquí) + culo(s)
Agente oxidante: cobre (Cu)
Agente reductor: hidrógeno (H)
tercero zinc(s) + 2H+(aquí) → zinc2+(aquí) + H2(gramo)
Oxidante: hidrógeno (H)
Agente reductor: zinc (Zn)
Adquiere más conocimientos con los contenidos:
- ¿Qué son las pilas?
- electroquímica
- Electrólisis
Referencias bibliográficas
FONSECA, M. r METRO química, 2. 1. edición São Paulo: Ática, 2013.
SANTOS, WLP; MOL, G. S. Química ciudadana, 3. 2. edición São Paulo: Editora AJS, 2013.
UBERCO, J. Conectar química, 2: química. - 2. edición São Paulo: Saraiva, 2014.


