LA Ley de la velocidad de reacción relaciona la velocidad de una transformación química con las concentraciones de reactivos en cantidad de materia (mol / L), que se pueden expresar de la siguiente manera:

Por ejemplo, considere la siguiente reacción genérica:
aA + bB → cC + dD
Digamos que aumentamos la concentración de los reactivos A y B, ¿qué pasará con la velocidad de la reacción? Bueno, como la cantidad de partículas reactivas aumentará en el mismo espacio, habrá colisiones más efectivas entre ellas, lo que resultará en un aumento en la velocidad de desarrollo de la reacción. Lo que significa que aumentará tu velocidad.
Por tanto, la velocidad de reacción es directamente proporcional a la concentración de los reactivos. Sin embargo, también depende de la temperatura. Por lo tanto, tenemos la siguiente ecuación matemática que representa la ley de la velocidad de reacción:

En que:
v = velocidad de reacción;
k = constante que solo depende del valor de temperatura;
α y β = exponentes determinados experimentalmente.
Solo cuando la reacción es elemental, es decir, ocurre en un solo paso, los exponentes son exactamente iguales a los coeficientes de la ecuación química balanceada: v = k. [LA]La. [B]B. Sin embargo, en otros casos, debe determinarse experimentalmente la potencia adecuada a la que debe elevarse la concentración de cada reactivo.
No pares ahora... Hay más después de la publicidad;)
La ley de la velocidad de las reacciones tiene muchos nombres, aquí hay algunos: Ley de Acción de Masas, Ecuación de Rapidez, Ley de Reacción Cinética y Ley de Guldberg-Waage.
Considere un ejemplo de cómo aplicar esta ley:
Considere la siguiente reacción elemental:
2 HCl (gramo) → H2 (g) + Cl2 (g)
a) Escribe la ecuación para la velocidad de esta reacción;
b) Mediante experimentos, la velocidad de esta reacción de descomposición del gas cloruro de hidrógeno y la concentración de este reactivo, a una temperatura constante de 25 ° C, se anotaron en la siguiente tabla:
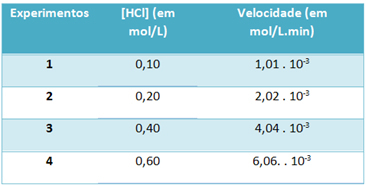
Con base en esto, determine la constante de velocidad característica de esta reacción a la temperatura mencionada.
Resolución:
La) v = k. [HCl]2
b) v = k. [HCl]2
k = __v___
[HCl]2
k = 1,01. 10-3 mol. L-1. min-1
0,01 mol. L-1
k = 1,01. 10-1 min-1
Para resolver la letra “b”, puedes usar los datos de cualquiera de los experimentos que el valor obtenido será el mismo.
Pero, ¿y si la reacción no es elemental? ¿Cómo será posible resolver cuestiones como estas en reacciones no elementales? Para saber cómo, lea la Ley de la velocidad para reacciones no elementales.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Ley de la velocidad de las reacciones químicas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/lei-velocidade-das-reacoes-quimicas.htm. Consultado el 27 de junio de 2021.


