LA batería Es un sistema donde tiene lugar la reacción de oxidación-reducción. En este dispositivo, la energía química producida en la reacción espontánea se convierte en energía eléctrica.
Las reacciones de oxidación y reducción ocurren simultáneamente en una célula. Cuando una especie se oxida, dona electrones a la otra especie, la cual, al recibirlos, se reduce.
Por lo tanto, el que se oxida es el agente reductor y el que se reduce es el agente oxidante.
LA oxidación ocurre cuando una especie pierde electrones y se convierte en un catión: A → A+ + y-.
LA reducción ocurre cuando una especie gana electrones y se vuelve eléctricamente neutra: B+ + y- → B.
En las ecuaciones químicas, esto transferencia de electrones se demuestra por el cambio en el número de oxidación (nox).
Las reacciones de reducción ocurren dentro de las celdas y la corriente eléctrica surge con la migración de electrones del polo negativo al positivo.

¿Cómo funciona una pila?
Una reacción quimica de óxidoreduccioón generalmente se puede representar mediante la ecuación:
A + B+ → un+ + B
Dónde,
A: sustancia que se oxida, pierde electrones, aumenta su valor y es el agente reductor.
B: sustancia que sufre reducción, gana electrones, disminuye la oxidación y es el agente oxidante.
Vea en la siguiente imagen cómo se puede representar este proceso.
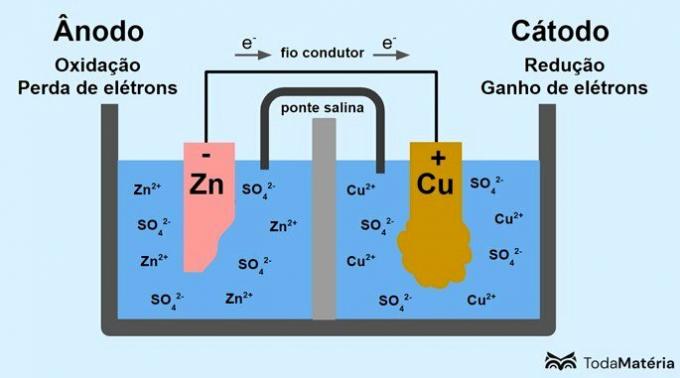
El sistema dividido en dos semiceldas y formado por dos electrodos metálicos conectados externamente por un hilo conductor fue desarrollado por John Frederic Daniell (1790-1845) en 1836.
La batería consta de dos electrodos, conectados por un hilo conductor, y un electrolito, donde se encuentran los iones. El electrodo es la superficie sólida conductora que permite el intercambio de electrones.
ánodo: electrodo en el que se produce la oxidación. También es el polo negativo de la batería.
Cátodo: electrodo en el que se produce la reducción. También es el polo positivo de la batería.
En la imagen de arriba, el zinc metálico es el ánodo y se somete a la oxidación. El cobre metálico es el cátodo y sufre reducción. La migración de electrones (e-) se produce del ánodo al cátodo a través del hilo conductor.
Las reacciones que ocurren en el sistema de imagen son:
- ánodo (oxidación): Zn(s) → zinc2(aquí) + 2e-
- Cátodo (reducción): Cu2+(aquí) + 2e- → culo(s)
- ecuación general: zinc(s) + culo2+(aquí) → culo(s) + zinc2+(aquí)
El zinc es un metal con mayor tendencia a perder electrones y, por tanto, se forman cationes en la disolución. El electrodo de zinc comienza a desgastarse y perder masa debido a que el zinc se libera en la solución al formar cationes Zn2+.
Los electrones del ánodo llegan al cátodo y los cationes metálicos, al recibirlos, se transforman en cobre metálico, que se deposita sobre el electrodo y aumenta su masa.
El puente salino es una corriente iónica responsable de la circulación de iones en el sistema para mantenerlo eléctricamente neutro.
Lea también sobre número de oxidación (nox).
tipos de batería
En una celda, la tendencia de las especies químicas a recibir o donar electrones está determinada por el potencial de reducción.
El componente con el mayor potencial de reducción tiende a reducirse, es decir, a ganar electrones. La especie con el potencial de reducción más bajo y, en consecuencia, el potencial de oxidación más alto, tiende a transferir electrones.
Por ejemplo, en la reacción redox Zn0(s) + culo2+(aquí) → culo0(s) + zinc2+(aquí)
El zinc se oxida y dona electrones porque tiene un potencial de reducción E0 = -0.76V, menos que el potencial de reducción del cobre E0 = +0,34V y, por tanto, recibe electrones y sufre reducción.
Vea a continuación otros ejemplos de pilas.
Pila de zinc e hidrógeno
Semirreacción de oxidación: Zn(s) → zinc2+ + 2e- (Y0 = -0,76 V)
Semireacción de reducción: 2H+(aquí) + 2e- → H2(g) (Y0 =0.00V)
Ecuación global: Zn(s) + 2H+(aquí) → zinc2+(aquí) + H2(g)
Representación de pila:
Pila de cobre e hidrógeno
Semirreacción de oxidación: H2(g) → 2H+(aquí) + 2e- (Y0 = 0,00 V)
Semireacción de reducción: Cu2+(aquí) + 2e- → culo(s) (Y0 = +0,34 V)
Ecuación Global: Cu2+(aquí) + H2(g) → 2H+(aquí) + culo(s)
Representación de pila:
Obtenga más conocimiento sobre el tema con los contenidos:
- electroquímica
- Electrólisis
Referencias bibliográficas
FONSECA, M. r METRO. química, 2. 1. edición São Paulo: Ática, 2013.
SANTOS, WLP; MOL, G. S. Química ciudadana, 3. 2. edición São Paulo: Editora AJS, 2013.
UBERCO, J. Conectar química, 2: química. - 2. edición São Paulo: Saraiva, 2014.