Uno Reacción reversible ocurre cuando es posible transformar los productos nuevamente en los reactivos. Este tipo de reacción entra en equilibrio químico cuando la velocidad de desarrollo de la reacción directa, es decir, la reacción con el consumo de reactivos y la formación de Los productos ocurren a la misma velocidad que la reacción inversa: formación de reactivos y consumo de productos.
Este tipo de reacciones equilibradas se ven mucho en la vida cotidiana. Un ejemplo es lo que ocurre en las cuevas, en la formación de las llamadas estalactitas y estalagmitas.
El agua subterránea está sujeta a altas presiones, por lo que contiene grandes cantidades de dióxido de carbono (CO2 (g)) disuelto en él. Al pasar por suelos que contienen piedra caliza (CaCO3 (s)), este carbonato se disuelve y se forman cuevas, según la siguiente reacción:
CaCO3 (s) + CO2 (g) + H2O(1) → Ca2+(aquí) + 2 HCO-3 (aq)
Sin embargo, los iones de carbonato y calcio pueden reaccionar y volver a precipitar como carbonato de calcio. Esto se demuestra por la reacción:
Aquí2+(aquí) + 2 HCO-3 (aq)→ CaCO3 (s) + CO2 (g) + H2O(1)
No pares ahora... Hay más después de la publicidad;)
Como habrás notado, una reacción es exactamente opuesta a la otra: los reactivos se convierten en productos y los productos en reactivos. Entonces, podemos representar esta reacción en equilibrio de la siguiente manera:
CaCO3 (s) + CO2 (aq) + H2O(1) Aquí2+(aquí) + 2 HCO-3 (aq)
Aquí2+(aquí) + 2 HCO-3 (aq)
La disposición lenta y continua del carbonato de las gotitas mineralizadas del techo de las cuevas escurren, su agua se evapora y se libera CO2. De modo que el equilibrio químico se desplaza en la dirección opuesta (de formación de los reactivos), de ahí el CaCO3 (s) se forma, es decir, el estalactitas en el techo de las cuevas. Al caer, la gota aún ha disuelto el carbonato, que se deposita en el suelo de la cueva, formando el estalagmitas.
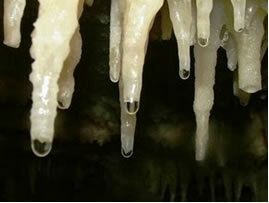
Agua con goteo de piedra caliza para la formación de estalactitas y estalagmitas
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Equilibrio químico en las cuevas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/equilibrio-quimico-nas-cavernas.htm. Consultado el 28 de junio de 2021.


