Kp es el acrónimo utilizado para determinar el constante de un equilibrio en términos de presiones parciales. Esta constante trabaja con los valores de los participantes gaseosos de un equilibrio en la unidad atm, por ejemplo.

Ecuación que representa una reacción química con componentes gaseosos
En esta ecuación, todos los participantes son gaseosos, por lo que cuando un gas participante tiene un presión parcial en la mezcla, está representado por la abreviatura pX.
Al establecer la ecuación de equilibrio químico (en términos de concentración), los productos deben colocarse en el numerador y los reactivos en el denominador:
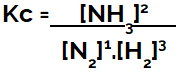
Kc expresión del equilibrio de formación de amoniaco
la expresión de constante de equilibrio en términos de presión (Kp) sigue el patrón de Kc, es decir, las presiones parciales de los reactivos se colocan en el denominador y las presiones parciales de los productos en el numerador:
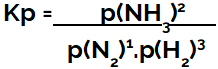
Expresión de Kp del equilibrio de formación de amoniaco
Observación: Si la ecuación de reacción del
equilibrio químico no presente ningún participante gaseoso, no presentará automáticamente Kp.Ejemplo: (PUC-MG) Para la reacción: 2 CO(gramo) + O2 (g)? 2 CO2 (g), las presiones parciales de CO(gramo) es el2 (g) en equilibrio son, respectivamente, 0,2 atm y 0,4 atm. La presión total del sistema es de 1,4 atm. El valor de Kp porque la reacción es:
a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
Los datos que aporta el ejercicio son:
Presión parcial de monóxido de carbono (pCO) = 0,2 atm;
Presión parcial de monóxido de carbono (pO2) = 0,4 atm;
Presión total = 1,4 atm;
Para determinar el Kp de este sistema, debemos realizar los siguientes pasos:
1er paso: Determine la presión parcial de monóxido de carbono (pCO2).
Para esto, recuerde que la presión total (pt) es la suma de todas las presiones parciales:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2do paso: Determine el Kp del ejercicio.
Para ello, basta con utilizar los valores en la expresión de la constante de equilibrio Kp:
Kp = (pCO2)2
(pCO)2.(polvo2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atmósferas-1
Por mí. Diogo Lopes Dias
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm
