La química orgánica es un área amplia de la química que estudia los compuestos de carbono.
El conocimiento de la Química Orgánica se aborda de varias formas y, pensando en ello, hemos reunido ejercicios propuestos, exámenes de acceso y preguntas Enem para que pongas a prueba tus conocimientos.
También use los comentarios de resoluciones para aprender aún más sobre el tema.
Ejercicios propuestos
Pregunta 1
Mire los compuestos orgánicos a continuación e identifique las funciones orgánicas de acuerdo con los grupos funcionales resaltados. Después de eso, nombre las sustancias.
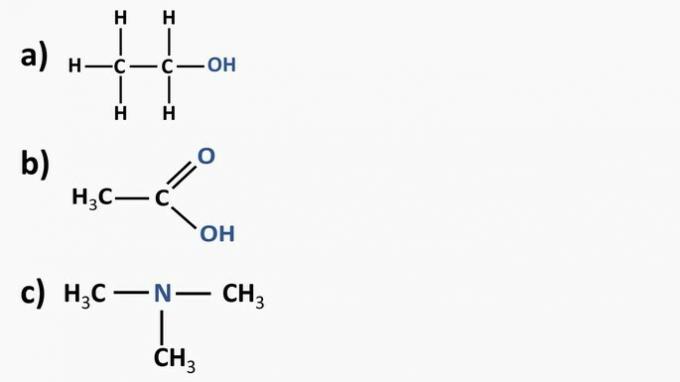
Respuesta:
a) Compuesto orgánico: etanol
- función orgánica: alcohol
- Fórmula general: R — OH
- Identificación: hidroxilo (OH) ligado a la cadena de carbono
b) Compuesto orgánico: ácido etanoico.
- Función orgánica: ácido carboxílico
- Fórmula general: R — COOH
- Identificación: radical carboxílico (COOH) ligado a la cadena de carbono
c) Compuesto orgánico: trimetilamina
- Función orgánica: amina (terciaria)
- Formula general:
- Identificación: nitrógeno unido a tres cadenas de carbono
Pregunta 2
En química orgánica, los compuestos se reconocen por las cadenas formadas por carbono e hidrógeno. Sin embargo, otros elementos pueden formar parte de la estructura química de estos compuestos, como el oxígeno.
Seleccione la alternativa donde los dos compuestos orgánicos tengan funciones orgánicas oxigenadas.
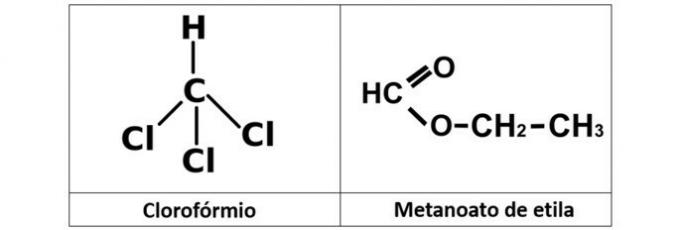
a) cloroformo y metanoato de etilo
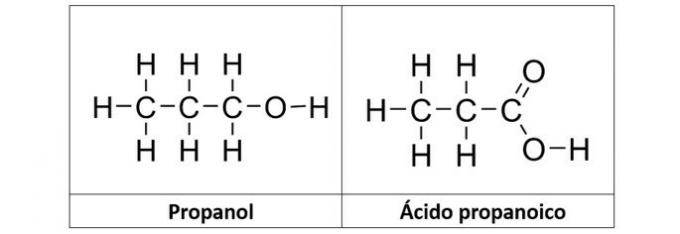
b) propanol y ácido propanoico
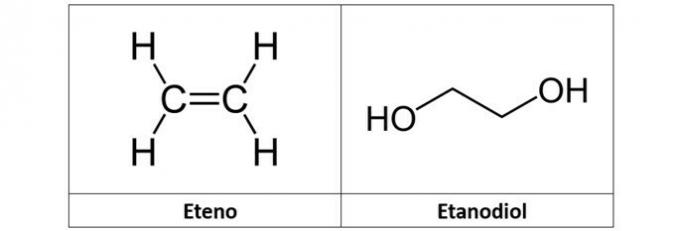
c) eteno y etanodiol
d) etanamida y benceno
Respuesta correcta: b) propanol y ácido propanoico
un error. Tenemos cloroformo (CHCl3), que es un haluro de alquilo, y el éster de metanoato de etilo (C3H6O2), que contiene oxígeno en su estructura.
b) CORRECTO. En esta alternativa tenemos dos compuestos que tienen funciones orgánicas oxigenadas. El propanol (C3H8O) es un alcohol formado por tres carbonos. El ácido propanoico (C3H6O2) es un ácido carboxílico.
c) INCORRECTO. El etileno (C2H4), también llamado etileno, es un hidrocarburo de tipo alqueno. Ya el etanodiol (C2H6O2) es un alcohol con dos hidroxilos en su estructura.
d) INCORRECTO. Etanamida (C2H5NO) es una amida y el benceno es un hidrocarburo aromático y, por tanto, está formado únicamente por carbono e hidrógeno.

Pregunta 3
Mire la estructura del compuesto orgánico a continuación y verifique las afirmaciones verdaderas.

(01) El compuesto tiene una función de nitrógeno orgánico.
(02) Es una amina primaria, ya que está unida a un solo hidrógeno.
(03) El nombre del compuesto es dietilamina.
Respuesta correcta:
(01) CORRECTO. La función orgánica nitrogenada presente en el compuesto es amina.
(02) INCORRECTO. Es una amina secundaria, ya que el nitrógeno está unido a dos cadenas de carbono.
(03) INCORRECTO. El nombre del compuesto es dimetilamina, ya que hay dos radicales metilo unidos al nitrógeno.
pregunta 4
El eugenol, miembro de la familia de los fenilpropanoides, es un compuesto orgánico aromático presente en el clavo, una especia utilizada desde la antigüedad.

Observe la fórmula estructural del compuesto e identifique las funciones orgánicas presentes.
a) Alcohol y éter
b) Fenol y éter
c) Alcohol y éster
d) Fenol y éster
e) Alcohol e hidrocarburo
Alternativa correcta: b) Fenol y éter.
El eugenol tiene funciones orgánicas oxigenadas en su cadena, es decir, además de los átomos de carbono e hidrógeno, el oxígeno es un heteroátomo presente.
La función orgánica del fenol se caracteriza por el hidroxilo (-OH) unido a un anillo aromático. En la función de éter, el oxígeno se encuentra entre dos cadenas de carbono.
pregunta 5
El EDTA, cuyo nombre completo es ácido etilendiaminotetraacético, es un compuesto orgánico con muchas aplicaciones. Su capacidad para unir iones metálicos lo convierte en un agente quelante muy utilizado tanto en el laboratorio como en la industria.
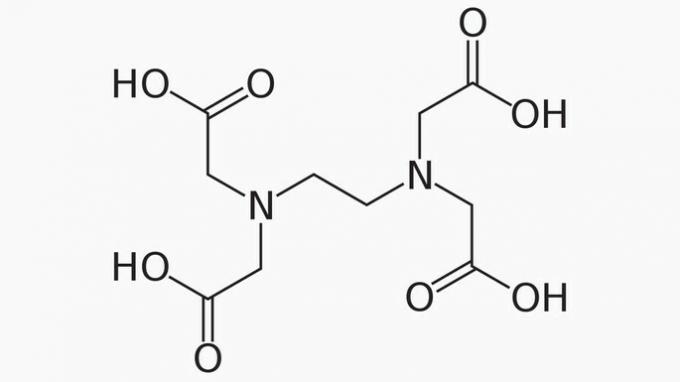
Sobre el EDTA, es correcto afirmar que la cadena de carbono es:
a) Abiertos, homogéneos e insaturados.
b) Cerrado, heterogéneo y saturado.
c) Abiertos, heterogéneos e insaturados.
d) Cerrado, homogéneo y saturado.
e) Abiertos, heterogéneos y saturados.
Respuesta correcta: e) Abierta, heterogénea y saturada.
La cadena EDTA se clasifica en:
ABIERTO. Según la disposición de los átomos de carbono en la estructura del EDTA, podemos ver que, debido a la presencia de extremos, la cadena del compuesto se abre.
HETEROGÉNEO. Además de los compuestos de carbono e hidrógeno, la cadena de carbono tiene heteroátomos de nitrógeno y oxígeno.
SATURADO. Los enlaces entre los átomos de carbono están saturados, ya que la cadena solo tiene enlaces simples.
Obtenga más información en: Química Orgánica.
preguntas del examen de ingreso
Pregunta 1
(UFSC) Observe las estructuras orgánicas incompletas e identifique los elementos correctos:
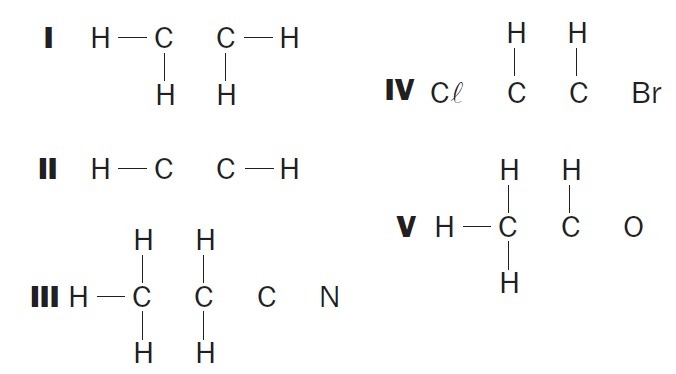
(01) La estructura I carece de un enlace sencillo entre los átomos de carbono.
(02) La Estructura II carece de un triple enlace entre los átomos de carbono.
(03) La Estructura III carece de dos enlaces simples entre los átomos de carbono y un triple entre los átomos de carbono y nitrógeno.
(04) La Estructura IV carece de dos enlaces simples entre átomos de carbono y halógenos y un enlace doble entre átomos de carbono.
(05) La Estructura V carece de un enlace sencillo entre los átomos de carbono y un enlace sencillo entre los átomos de carbono y oxígeno.
Alternativas correctas: 02, 03 y 04.
Además del carbono, un elemento químico obligatorio en los compuestos orgánicos, otros elementos pueden estar presentes en estructuras y unidos por enlaces covalentes, donde los electrones se comparten.
La valencia de los elementos determina el número de enlaces que se pueden formar, como se muestra en la siguiente tabla.
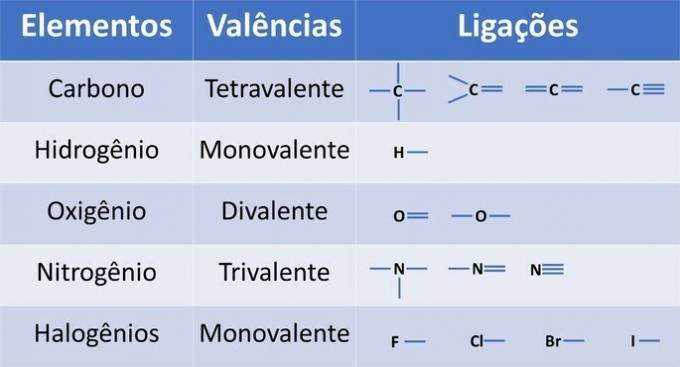
De esta información, tenemos:
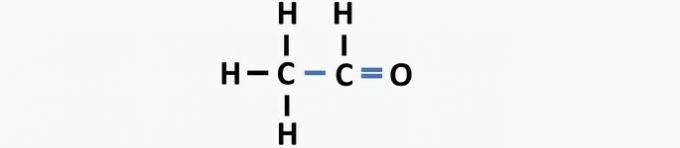
(01) INCORRECTO. La estructura carece de un doble enlace entre los átomos de carbono para formar el compuesto de eteno.
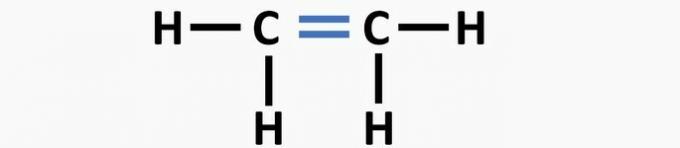
(02) CORRECTO. La estructura carece de un triple enlace entre los átomos de carbono para formar el compuesto de etino.
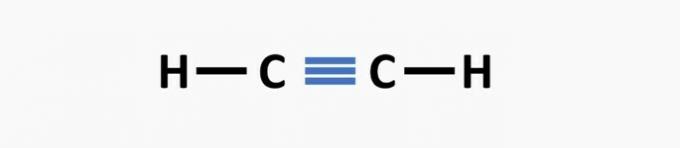
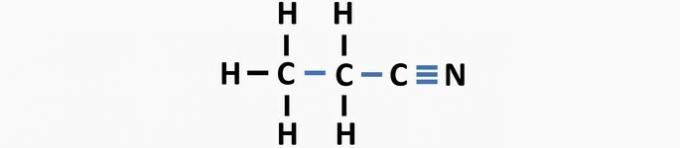
(03) CORRECTO. La estructura carece de enlaces simples entre carbonos y enlaces triples entre carbono y nitrógeno para formar el compuesto propanonitrilo.
(04) CORRECTO. La estructura carece de enlaces simples entre carbono y halógeno, y dobles enlaces entre carbonos para formar el compuesto de dicloroeteno.
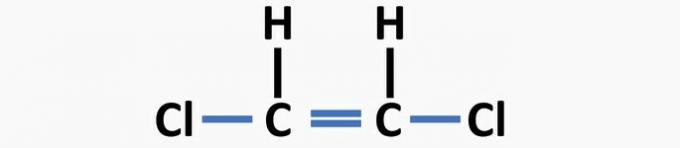
(05) INCORRECTO. La estructura carece de un enlace simple entre los carbonos y un enlace doble entre el carbono y el oxígeno para formar el compuesto etanal.
Pregunta 2
(UFPB) La estructura del compuesto orgánico de fórmula molecular C5H8Lo que presenta una cadena ramificada, insaturada, heterogénea y alicíclica es:

Alternativa correcta: d.
Las cadenas de carbono se pueden clasificar de la siguiente manera:
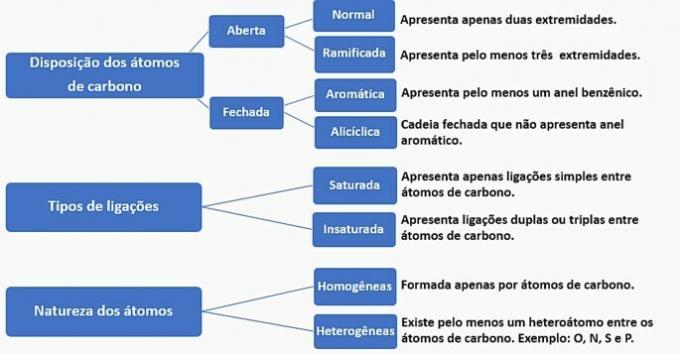
Según esta información, tenemos:
un error. La cadena se clasifica en normal, saturada, homogénea y alicíclica.
b) INCORRECTO. La cadena se clasifica en normal, insaturada, homogénea y abierta.
c) INCORRECTO. La cadena se clasifica en ramificada, insaturada, homogénea y abierta.
d) CORRECTO. La cadena se clasifica en ramificada, insaturada, heterogénea y alicíclica, como
- Tiene una rama: radical metilo;
- Tiene insaturación: doble enlace entre carbonos;
- Tiene un heteroátomo: oxígeno unido a dos carbonos;
- Presenta una cadena cerrada: carbonos enlazados en círculo sin presencia de anillo aromático.
e) INCORRECTO. La cadena se clasifica en ramificada, insaturada, heterogénea y abierta.
Pregunta 3
(Centec-BA) En la estructura que se muestra a continuación, los carbonos numerados son, respectivamente:
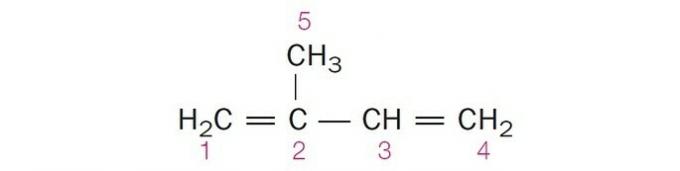
Las p2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Alternativa correcta: c) sp2, sp2, sp2, sp2, sp3.
Debido a que tiene 4 electrones en la capa de valencia, el carbono es tetravalente, es decir, tiene tendencia a formar 4 enlaces covalentes. Estos enlaces pueden ser simples, dobles o triples.
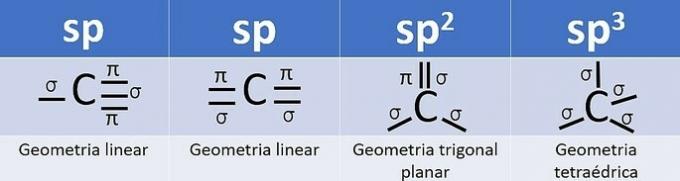
El número de orbitales híbridos es la suma de los enlaces sigma (σ) del carbono, ya que el enlace no hibrida.
- sp: 2 enlaces sigma
- sp2: 3 enlaces sigma
- sp3: 4 enlaces sigma
Según esta información, tenemos:
un error. El carbono 2 tiene hibridación sp2, ya que tiene 3 enlaces σ y un enlace .
b) INCORRECTO. El carbono no tiene hibridación sp4 y la hibridación sp ocurre cuando hay un triple enlace o dos dobles enlaces entre los carbonos.
c) CORRECTO. La suma de los enlaces σ en cada carbono da la hibridación alternativa.
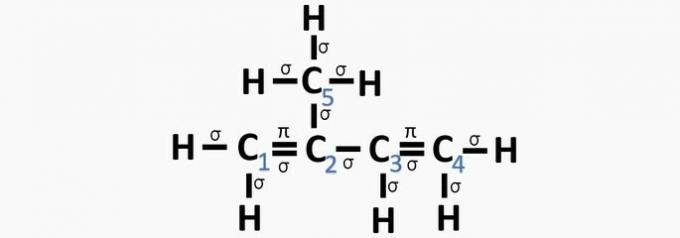
d) INCORRECTO. La hibridación Sp ocurre cuando hay un triple enlace o dos dobles enlaces entre los carbonos.
e) INCORRECTO. El carbono no tiene hibridación sp4 y la hibridación sp ocurre cuando hay un triple enlace o dos dobles enlaces entre los carbonos.
pregunta 4
(UFF) Existe una muestra gaseosa formada por uno de los siguientes compuestos: CH4; C2H4; C2H6; C3H6 o C3H8. Si 22 g de esta muestra ocupan un volumen de 24,6 L a una presión de 0,5 atm y una temperatura de 27 ° C (Dado: R = 0,082 L .atm. K–1.mol–1), se concluye que es el gas:
a) etano.
b) metano.
c) propano.
d) propeno.
e) eteno.
Alternativa correcta: c) propano.
1er paso: convierta la unidad de temperatura de Celsius a Kelvin.
2do paso: calcule el número de moles del compuesto usando la ecuación general del gas.
3er paso: calcular la masa molar del compuesto.
4to paso: encuentra el hidrocarburo que tiene una masa molar de 44 g / mol.
Metano
Ethene
Etano
propileno
Propano
Así, se concluye que el gas que corresponde a la información del comunicado es el propano.
pregunta 5
(ITA) Considere las siguientes sustancias:
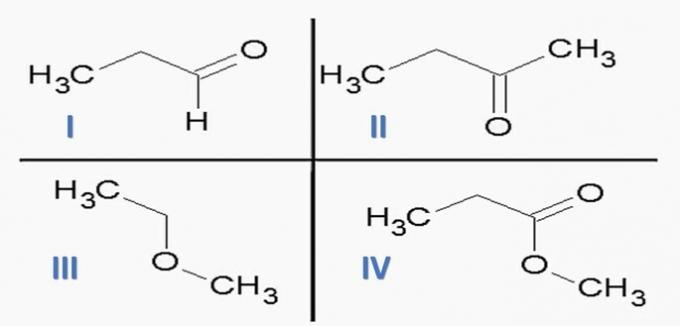
y las siguientes funciones químicas:
La. ácido carboxílico;
B. alcohol;
C. aldehído;
D. cetona
y. ester;
F. éter.
La opción que asocia CORRECTAMENTE sustancias con funciones químicas es:
ayuda; IIc; IIIe; IVf.
b) Ic; IId; IIIe; IVA
c) Ic; IId; IIIf; He.
hizo; IIc; IIIf; He.
e) Ia; IIc; IIIe; IVd.
Alternativa correcta: c) Ic; IId; IIIf; He.
Las funciones orgánicas están determinadas por estructuras y grupos de compuestos orgánicos con características similares.
Las funciones químicas presentes en las alternativas son:
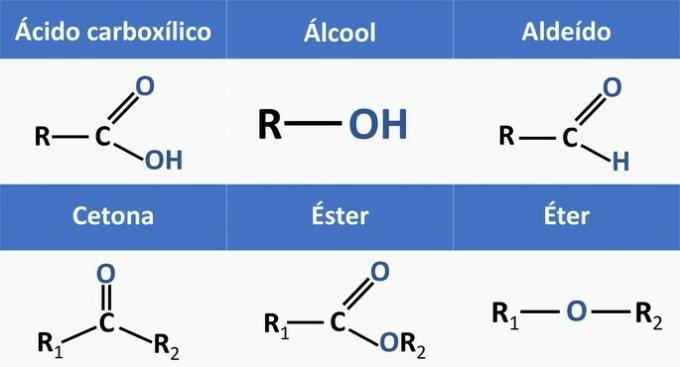
Analizando las estructuras anteriores y los compuestos presentes en la declaración, tenemos:
un error. Las funciones de los órganos son correctas, pero la secuencia es incorrecta.
b) INCORRECTO. No hay ácido carboxílico entre los compuestos.
c) CORRECTO. Los grupos funcionales presentes en los compuestos representan las siguientes funciones químicas.

d) INCORRECTO. I es aldehído y II es cetona.
e) INCORRECTO. No hay ácido carboxílico entre los compuestos.
Obtenga más información en: Funciones orgánicas.
Preguntas enem
Pregunta 1
(Enem / 2014) Un método para determinar el contenido de etanol en la gasolina consiste en mezclar volúmenes conocidos de agua y gasolina en una botella específica. Tras agitar el matraz y esperar un tiempo, se miden los volúmenes de las dos fases inmiscibles que se obtienen: una orgánica y otra acuosa. El etanol, una vez miscible con gasolina, ahora es miscible con agua.
Para explicar el comportamiento del etanol antes y después de la adición de agua, es necesario conocer
a) la densidad de los líquidos.
b) el tamaño de las moléculas.
c) el punto de ebullición de los líquidos.
d) los átomos presentes en las moléculas.
e) el tipo de interacción entre las moléculas.
Alternativa correcta: e) el tipo de interacción entre las moléculas.
Las fuerzas intermoleculares influyen en la solubilidad de los compuestos orgánicos. Las sustancias tienden a disolverse entre sí cuando tienen la misma fuerza intermolecular.
Vea en la tabla a continuación algunos ejemplos de funciones orgánicas y el tipo de interacción entre moléculas.
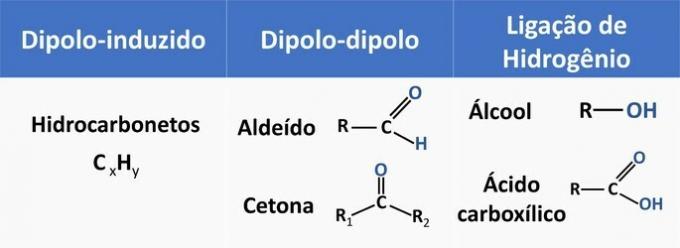
El etanol se considera un disolvente polar, ya que tiene un grupo polar (—OH) en su estructura. Sin embargo, su cadena de carbono, al ser no polar (CH), es capaz de interactuar con disolventes no polares. Por tanto, el etanol se solubiliza tanto en agua como en gasolina.
Según esta información, tenemos:
un error. La densidad relaciona la masa de un cuerpo con el volumen ocupado.
b) INCORRECTO. El tamaño de las moléculas influye en la polaridad de los compuestos: cuanto más grande es la cadena de carbono, más no polar se vuelve la sustancia.
c) INCORRECTO. El punto de ebullición es útil para separar moléculas: la destilación separa compuestos con diferentes puntos de ebullición. Cuanto más bajo es el punto de ebullición, más fácilmente se vaporiza la molécula.
d) INCORRECTO. Un aldehído tiene carbono, hidrógeno y oxígeno en su estructura. Este compuesto realiza interacciones dipolo-dipolo, mientras que un alcohol, que tiene los mismos elementos, es capaz de formar enlaces de hidrógeno.
e) CORRECTO. La interacción del etanol con el agua (puentes de hidrógeno) es más intensa que con la gasolina (inducida por diplo).
Pregunta 2
(Enem / 2013) Las moléculas de nanoputianos se asemejan a figuras humanas y fueron creadas para estimular el interés de los jóvenes por comprender el lenguaje expresado en fórmulas estructurales, ampliamente utilizado en química orgánica. Un ejemplo es NanoKid, representado en la figura:
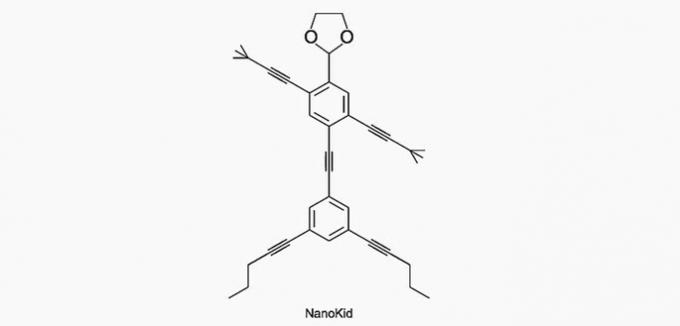
¿En qué parte del cuerpo del NanoKid hay carbono cuaternario?
a) Manos.
b) Cabeza.
c) Pecho.
d) Abdomen.
e) Pies.
Alternativa correcta: a) Manos.
El carbono se clasifica de la siguiente manera:
- Primario: se une a un carbono;
- Secundario: se une a dos carbonos;
- Terciario: se une a tres carbonos;
- Cuaternario: se une a cuatro carbonos.
Vea los ejemplos a continuación.

Según esta información, tenemos:
a) CORRECTO. El carbono de la mano está unido a otros cuatro carbonos, por lo que es cuaternario.
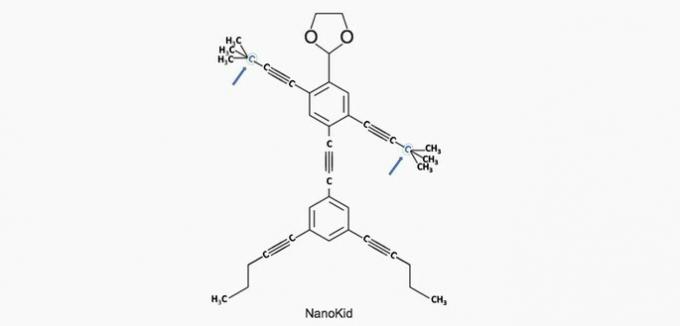
b) INCORRECTO. La cabeza está formada por carbonos primarios.
c) INCORRECTO. El cofre está formado por carbonos secundarios y terciarios.
d) INCORRECTO. El abdomen está formado por carbonos secundarios.
e) INCORRECTO. Los pies están formados por carbonos primarios.
Pregunta 3
(Enem / 2014) Algunos materiales poliméricos no pueden utilizarse para la producción de ciertos tipos de artefactos, ni para limitaciones de las propiedades mecánicas, ya sea por la facilidad con la que sufren degradación, generando subproductos indeseables para ese solicitud. Por lo tanto, la inspección se vuelve importante para determinar la naturaleza del polímero utilizado en la fabricación del artefacto. Uno de los posibles métodos se basa en la descomposición del polímero para generar los monómeros que le dieron origen.
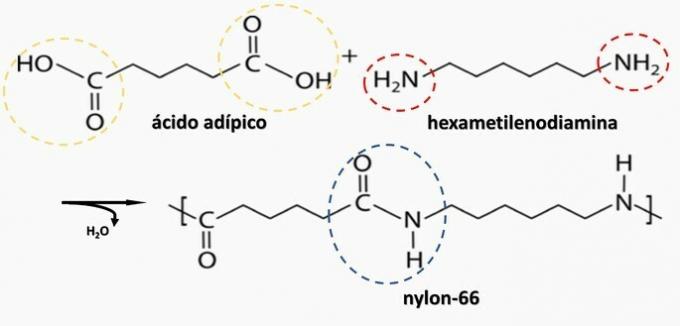
Descomposición controlada de un artefacto generado diamina H2N (CH2)6NUEVA HAMPSHIRE2 y el diacido HO2C (CH2)4CO2H. Por lo tanto, el artefacto estaba hecho de
a) poliéster.
b) poliamida.
c) polietileno.
d) poliacrilato.
e) polipropileno.
Alternativa correcta: b) poliamida.
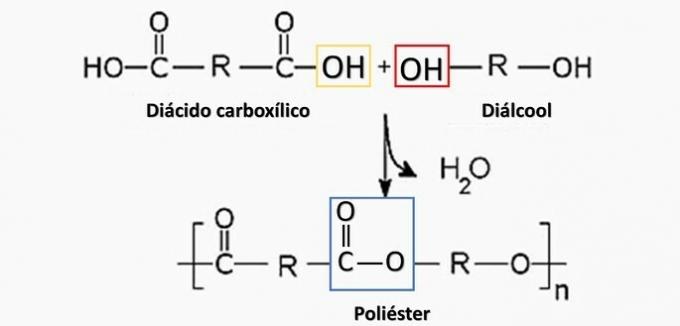
un error. El poliéster se forma en la reacción entre un ácido dicarboxílico (-COOH) y un dialcohol (-OH).
b) CORRECTO. La poliamida se forma mediante la polimerización de un ácido dicarboxílico (—COOH) con una diamina (—NH2).
c) INCORRECTO. El polietileno se forma en la polimerización del monómero de etileno.
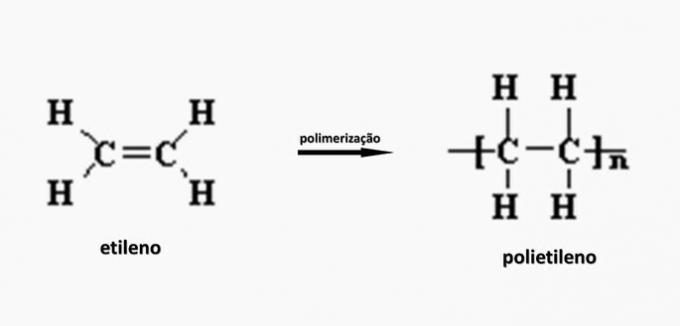
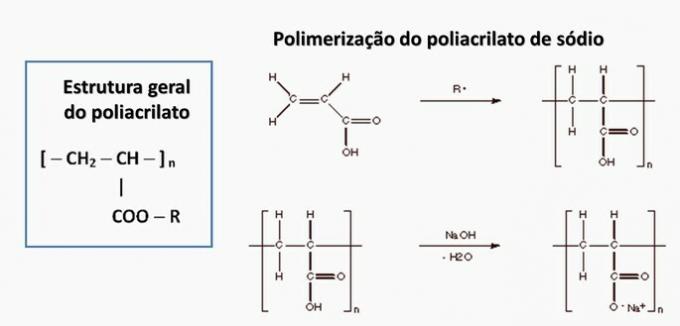
d) INCORRECTO. El poliacrilato está formado por una sal derivada del ácido carboxílico.
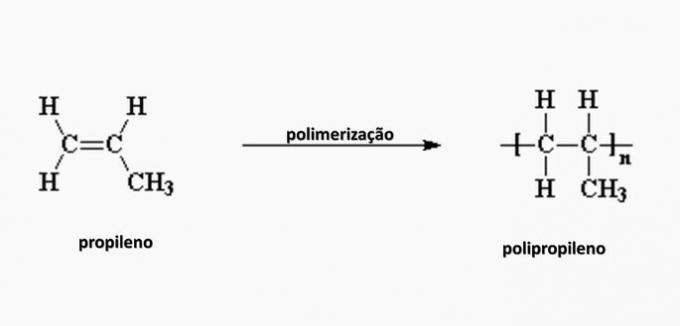
e) INCORRECTO. El polipropileno se forma en la polimerización del monómero de propileno.
pregunta 4
(Enem / 2008) China se ha comprometido a indemnizar a Rusia por el derrame de benceno de una industria Petroquímicos chinos en el río Songhua, un afluente del río Amur, que forma parte de la frontera entre los dos países. El presidente de la Agencia Federal de Recursos Hídricos de Rusia aseguró que el benceno no llegará a las tuberías de agua potable, pero pidió a la población que hierva el agua corriente y evite pescar en el río Amur y su afluentes. Las autoridades locales están almacenando cientos de toneladas de carbón, ya que el mineral se considera un absorbente de benceno eficaz. Internet: (con adaptaciones). Teniendo en cuenta las medidas adoptadas para minimizar los daños al medio ambiente y a la población, es correcto afirmar que
a) el carbón, cuando se coloca en agua, reacciona con el benceno eliminándolo.
b) el benceno es más volátil que el agua y, por lo tanto, debe hervirse.
c) la orientación para evitar la pesca se debe a la necesidad de preservar el pescado.
d) el benceno no contaminaría las tuberías de agua potable, ya que se decantaría naturalmente en el fondo del río.
e) la contaminación causada por el derrame de benceno de la industria china se limitaría al río Songhua.
Alternativa correcta: b) el benceno es más volátil que el agua y por tanto es necesario que se hierva.
un error. El carbón contiene en su estructura varios poros y se utiliza como adsorbente, ya que es capaz de interactuar con los contaminantes y retenerlos en su superficie, pero no eliminarlos.
b) CORRECTO. Cuanto mayor es la volatilidad de una sustancia, más fácilmente cambia a estado gaseoso. Mientras que el punto de ebullición del agua es de 100 ° C, el del benceno es de 80,1 ° C. Esto se debe a que el agua es un compuesto polar y el benceno es un compuesto no polar.
El tipo de interacciones que hacen las moléculas son diferentes y también afectan el punto de ebullición de las sustancias. La molécula de agua es capaz de formar enlaces de hidrógeno, un tipo de interacción mucho más fuerte que la que puede formar el benceno con el dipolo inducido.
c) INCORRECTO. En una cadena alimentaria, un ser se convierte en el alimento de otro según las interacciones de las especies en un lugar. Cuando una sustancia tóxica se libera en un medio ambiente, se produce una acumulación progresiva y los peces contaminado, cuando es ingerido por el hombre, puede llevar benceno con ellos y causar mutaciones en el ADN e incluso incluso cáncer.
d) INCORRECTO. El benceno tiene una densidad más baja que el agua. Por tanto, la tendencia es que incluso bajo el agua se siga extendiendo.
e) INCORRECTO. Los cambios estacionales pueden agravar aún más el problema, ya que las bajas temperaturas disminuyen la capacidad de descomposición biológica de los productos químicos por la acción del sol o las bacterias.
pregunta 5
(Enem / 2019) Los hidrocarburos son moléculas orgánicas con una serie de aplicaciones industriales. Por ejemplo, están presentes en grandes cantidades en varias fracciones de petróleo y normalmente se separan mediante destilación fraccionada en función de su temperatura de ebullición. La tabla presenta las principales fracciones obtenidas en la destilación del petróleo a diferentes rangos de temperatura.
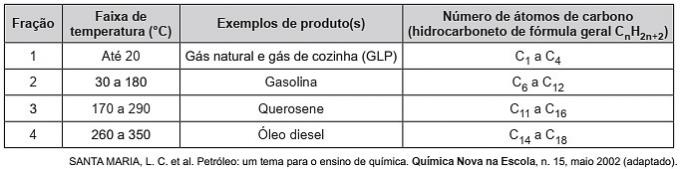
En la fracción 4, la separación de compuestos ocurre a temperaturas más altas porque
a) sus densidades son mayores.
b) el número de sucursales es mayor.
c) su solubilidad en aceite es mayor.
d) las fuerzas intermoleculares son más intensas.
e) la cadena de carbono es más difícil de romper.
Alternativa correcta: d) las fuerzas intermoleculares son más intensas.
Los hidrocarburos interactúan por dipolo inducido y este tipo de fuerza intermolecular se intensifica con el aumento de la cadena de carbono.
Por lo tanto, las fracciones de petróleo más pesadas tienen una temperatura de ebullición más alta, ya que las cadenas interactúan más fuertemente por un dipolo inducido.
Para más ejercicios, con resolución comentada, vea también:
- Ejercicios sobre hidrocarburos
- Ejercicios sobre funciones orgánicas
- Preguntas de química en Enem