O equilibrio de ecuaciones nos permite hacer coincidir el número de átomos presentes en la ecuación química para que se vuelva verdadera y represente una reacción química.
Utilice las preguntas a continuación para probar sus conocimientos y verifique las respuestas comentadas después de los comentarios para responder a sus preguntas.
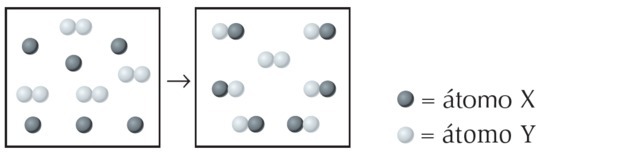
Pregunta 1
(Mackenzie-SP)
Suponiendo que los círculos vacíos y llenos significan respectivamente átomos diferentes, entonces el esquema anterior representará una reacción química equilibrada si reemplazamos las letras X, Y y W, respectivamente, con la valores:
a) 1, 2 y 3.
b) 1, 2 y 2.
c) 2, 1 y 3.
d) 3, 1 y 2.
e) 3, 2 y 2.
Alternativa d) 3, 1 y 2.
1er paso: Asignamos letras para que la ecuación sea más fácil de entender.
2do paso: sumamos los índices para averiguar quién tiene más átomos en la ecuación.
| LA | |
| B |
A y B aparecen solo una vez en cada miembro de la ecuación. Sin embargo, si sumamos los índices, vemos que A tiene el valor más alto. Por lo tanto, comenzamos a equilibrar por él.
3er paso: Equilibramos el elemento A transponiendo los índices y convirtiéndolos en coeficientes.

Observamos que el elemento B se equilibró automáticamente y los coeficientes de la ecuación son: 3, 1 y 2.
Pregunta 2
(Unicamp-SP) Lea la siguiente oración y transfórmela en una ecuación química (balanceada), usando símbolos y fórmulas: “una molécula de nitrógeno gaseoso, que contiene dos átomos de nitrógeno por molécula, reacciona con tres moléculas de hidrógeno gaseoso diatómico, produciendo dos moléculas de amoníaco gaseoso, que se compone de tres átomos de hidrógeno y uno de nitrógeno".
Respuesta:
Al representar los átomos descritos en la pregunta, podemos entender que la reacción ocurre de la siguiente manera:

Entonces llegamos a la ecuación:
Pregunta 3
El peróxido de hidrógeno es un compuesto químico que puede descomponerse, formando agua y oxígeno, de acuerdo con la siguiente ecuación química.
Respecto a esta reacción, la ecuación correctamente balanceada es:
a) H2O2 → El2 + H2O
b) 2h2O2 → El2 + 2H2O
c) H2O2 → 2O2 + H2O
d) 2H2O2 → 2O2 + 2H2O
Alternativa correcta: b) 2H2O2 → El2 + 2H2O
Tenga en cuenta que el peróxido de hidrógeno es una sustancia química formada por átomos de dos elementos químicos: hidrógeno y oxígeno.
Después de la reacción de descomposición, debe tener el mismo número de átomos de los dos elementos tanto en los reactivos como en los productos. Para ello, necesitamos equilibrar la ecuación.
Tenga en cuenta que tenemos 2 átomos de hidrógeno en el reactivo (H2O2) y dos átomos en el producto (H2O). Sin embargo, el oxígeno tiene dos átomos en el reactivo (H2O2) y tres átomos en los productos (H2O y O2).
Si ponemos el coeficiente 2 antes del peróxido de hidrógeno duplicamos el número de átomos de los elementos.
Tenga en cuenta que si ponemos el mismo coeficiente junto con la fórmula del agua, tenemos la misma cantidad de átomos en ambos lados.
Por lo tanto, la ecuación química correctamente balanceada es 2H2O2 → El2 + 2H2O.
pregunta 4
(UFPE) Considere las siguientes reacciones químicas.
Podemos decir eso:
a) todos están equilibrados.
b) 2, 3 y 4 están equilibrados.
c) solo 2 y 4 están equilibrados.
d) solo 1 está desequilibrado.
e) ninguno está correctamente equilibrado, porque los estados físicos de los reactivos y productos son diferentes.
Alternativa b) 2, 3 y 4 están equilibrados.
Las alternativas 1 y 5 son incorrectas porque:
- La ecuación 1 está desequilibrada, el equilibrio correcto sería:
- La ecuación 5 es incorrecta porque el compuesto formado en la reacción sería H2SOLO3.
Para formar la H2SOLO4 debe incluirse en la ecuación la oxidación de SO2.
pregunta 5
(Mackenzie-SP) Calentado a 800 ° C, el carbonato de calcio se descompone en óxido de calcio (cal virgen) y dióxido de carbono. La ecuación correctamente equilibrada, que corresponde al fenómeno descrito, es:
(Dado: Ca - metal alcalinotérreo.)
Alternativa c)
El calcio es un metal alcalinotérreo y para tener estabilidad, el calcio necesita 2 electrones (Ca2+), que es la carga de oxígeno (O2-).
Por lo tanto, un átomo de calcio se une a un átomo de oxígeno y el compuesto formado es CaO, que es cal viva.
El otro producto es dióxido de carbono (CO2). Ambos están formados por carbonato de calcio (CaCO3).
Poniéndolo en una ecuación:
Observamos que las cantidades de átomos ya son correctas y no es necesario equilibrarlas.
pregunta 6
(UFMG) La ecuación no está equilibrado. Equilibrándolo con los números más pequeños posibles, la suma de los coeficientes estequiométricos será:
a) 4
b) 7
c) 10
d) 11
e) 12
Alternativa e) 12
Usando el método de prueba, el orden de equilibrio será:
1er paso: Como el elemento que aparece solo una vez en cada miembro y tiene el índice más alto es el calcio, comenzamos a equilibrarlo.
2do paso: Seguimos el balance por el radical PO43-, que también aparece una sola vez.
3er paso: equilibramos el hidrógeno.
Con esto, observamos que automáticamente se ajustó la cantidad de oxígeno y el balance de la ecuación es:
Recordando que cuando el coeficiente es 1 no es necesario escribirlo en la ecuación.
Sumando los coeficientes tenemos:
pregunta 7
La combustión es un tipo de reacción química en la que se libera energía en forma de calor.
En la combustión completa de una sustancia formada por carbono e hidrógeno, se forman dióxido de carbono y agua.
Observe las reacciones de combustión de hidrocarburos y responda cuál de las siguientes ecuaciones está incorrectamente equilibrada:
a) CH4 + 2O2 → CO2 + 2H2O
antes de Cristo3H8 +502 → 3CO2 + 4H2O
c) C4H10 + 13 / 3O2 → 4CO2 + 5h2O
d) C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Respuesta incorrecta: c) C4H10 + 13 / 3O2 → 4CO2 + 5h2O
Para equilibrar las ecuaciones químicas, primero veamos qué elemento aparece solo una vez en cada miembro de la ecuación.
Tenga en cuenta que el carbono y el hidrógeno forman solo un reactivo y un producto en cada ecuación presentada.
Entonces, comencemos a equilibrar con hidrógeno, ya que tiene una mayor cantidad de átomos.
Por tanto, el orden de ponderación será:
- Hidrógeno
- Carbón
- Oxígeno
Hidrógeno
Como el producto tiene 2 átomos de hidrógeno, insertamos un número como coeficiente que multiplicado por 2 da como resultado el número de átomos de hidrógeno en el reactivo.
a) CH4 + O2 → CO2 + 2H2O
antes de Cristo3H8 + O2 → CO2 + 4H2O
c) C4H10 + O2 → CO2 + 5H2O
d) C2H6 + O2 → CO2 + 3H2O
Carbón
El equilibrio se realiza transponiendo el índice de carbono en el reactivo y usándolo como coeficiente en el producto que tiene átomos de este elemento.
a) CH4 + O2 → 1CO2 + 2H2O
antes de Cristo3H8 + O2 → 3CO2 + 4H2O
c) C4H10 + O2 → 4CO2 + 5h2O
d) C2H6 + O2 → 2CO2 + 3H2O
Oxígeno
Sumando el número de átomos de oxígeno en los productos formados encontramos el número de átomos del elemento que debe estar reaccionando.
Para eso, debemos poner como coeficiente un número que multiplicado por 2 da como resultado el número de átomos de oxígeno en los productos.
a) CH4 + O2 → 1CO2 + 2H2O
2x = 2 + 2
2x = 4
x = 2
Entonces la ecuación correcta es: CH4 + 2O2 → 1CO2 + 2H2O.
antes de Cristo3H8 + O2 → 3CO2 + 4H2O
2x = 6 + 4
2x = 10
x = 5
Entonces la ecuación correcta es: C3H8 + 5O2 → 3CO2 + 4H2O
c) C4H10 + O2 → 4CO2 + 5h2O
2x = 8 + 5
2x = 13
x = 13/2
Entonces la ecuación correcta es: C4H10 + 13/2O2 → 4CO2+ 5h2O
d) C2H6 + O2 → 2CO2 + 3H2O
2x = 4 + 3
2x = 7
x = 7/2
Entonces la ecuación correcta es: C2H6 + 7/2O2 → 2CO2 + 3H2O
Las ecuaciones correctamente equilibradas son:
a) CH4 + 2O2 → CO2 + 2H2O
antes de Cristo3H8 +502 → 3CO2 + 4H2O
c) C4H10 + 13 / 2O2 → 4CO2 + 5h2O
d) C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Por tanto, la alternativa c) C4H10 + 13 / 3O2 → 4CO2 + 5h2El caso es que no tiene el equilibrio correcto.
pregunta 8
(Enem 2015) Las calizas son materiales compuestos de carbonato de calcio, que pueden actuar como absorbentes del dióxido de azufre (SO2), un importante contaminante del aire. Las reacciones involucradas en el proceso son la activación de la piedra caliza, a través de la calcinación, y la fijación de SO2 con la formación de una sal de calcio, como lo ilustran las ecuaciones químicas simplificadas.

Considerando las reacciones involucradas en este proceso de desulfuración, la fórmula química de la sal de calcio corresponde a:
Alternativa b)
Como la reacción está equilibrada, los átomos de los reactivos deben estar en la misma cantidad en los productos. De esa forma,
La sal formada está compuesta por:
1 átomo de calcio = Ca
1 átomo de azufre = S
4 átomos de oxígeno = O4
Por tanto, la fórmula química de la sal de calcio corresponde a CaSO4.
pregunta 9
(UFPI) La reacción de X con Y se muestra a continuación. Determina qué ecuación representa mejor la ecuación química balanceada.
Alternativa a)
En la figura observamos que la especie X es un solo átomo mientras que Y es diatómica, es decir, está formada por la unión de 2 átomos. Entonces X reacciona con Y2.
El producto formado está representado por XY, la ecuación está desequilibrada:
Equilibramos la ecuación de la siguiente manera:

De acuerdo con la ecuación balanceada, la siguiente figura nos muestra cómo ocurre la reacción y su proporción.

Para que ocurra una reacción, debe haber una proporción fija y, por lo tanto, es posible que algunos compuestos no reaccionen. Esto es lo que muestra la figura, porque en el producto vemos que una Y2 no reaccionó.
pregunta 10
(Enem 2010) Las movilizaciones para promover un planeta mejor para las generaciones futuras son cada vez más frecuentes. La mayoría de los medios de transporte masivo funcionan actualmente mediante la quema de un combustible fósil. Como ejemplo de la carga que genera esta práctica, basta saber que un automóvil produce, en promedio, unos 200 g de dióxido de carbono por km recorrido.
Revista Calentamiento Global. Año 2, 8. Publicación del Instituto Brasileiro de Cultura Ltda.
Uno de los principales componentes de la gasolina es el octano (C8H18). A través de la combustión de la energía del octanaje es posible, lo que permite que el automóvil comience a moverse. La ecuación que representa la reacción química de este proceso demuestra que:
a) el oxígeno se libera en el proceso, en forma de O2.
b) el coeficiente estequiométrico del agua es de 8 a 1 octano.
c) en el proceso hay consumo de agua, por lo que se libera energía.
d) el coeficiente estequiométrico para el oxígeno es de 12,5 a 1 octano.
e) el coeficiente estequiométrico para el dióxido de carbono es de 9 a 1 octano
Alternativa d) el coeficiente estequiométrico para el oxígeno es de 12,5 a 1 octano.
Al equilibrar la ecuación encontramos los siguientes coeficientes:

- Iniciamos el balanceo por hidrógeno que aparece solo una vez en cada miembro y tiene un índice más alto. Dado que hay 18 átomos de hidrógeno que reaccionan, hay 2 en el producto, por lo que debemos sumar un número que multiplicado por 2 da 18. Entonces 9 es el coeficiente.
- Luego sumamos el coeficiente 8 delante del CO2 tener 8 carbonos en cada miembro de la ecuación.
- Finalmente, simplemente agregue la cantidad de oxígeno en el producto y encuentre el valor que multiplicado por 2 nos da 25 átomos de oxígeno. Así que elegimos 25/2 o 12,5.
Así, para la combustión de 1 octano se consume 12,5 oxígeno.
pregunta 11
(Fatec-SP) Una característica esencial de los fertilizantes es su solubilidad en agua. Por tanto, la industria de los fertilizantes transforma el fosfato cálcico, cuya solubilidad en agua es muy baja, en un compuesto mucho más soluble, que es el superfosfato cálcico. Este proceso está representado por la ecuación:
donde los valores de x, y y z son, respectivamente:
a) 4, 2 y 2.
b) 3, 6 y 3.
c) 2, 2 y 2.
d) 5, 2 y 3.
e) 3, 2 y 2.
Alternativa e) 3, 2 y 2.
Usando el método algebraico, formamos ecuaciones para cada elemento y equiparamos el número de átomos en el reactivo con el número de átomos en el producto. Siendo así:
Ecuación equilibrada:
pregunta 12
Equilibre las ecuaciones siguientes utilizando el método de prueba.
Respuesta:
La ecuación está compuesta por los elementos hidrógeno y cloro. Equilibramos los elementos simplemente agregando el coeficiente 2 delante del producto.
No era necesario equilibrar la ecuación, ya que las cantidades de átomos ya están ajustadas.
El fósforo tiene dos átomos en los reactivos, por lo que para equilibrar este elemento ajustamos la cantidad de ácido fosfórico en el producto a 2H3POLVO4.
Luego de eso, observamos que el hidrógeno tenía 6 átomos en el producto, equilibramos la cantidad de este elemento agregando coeficiente 3 al reactivo que lo contiene.
Con los pasos anteriores, se fijó la cantidad de oxígeno.
Al observar la ecuación, vemos que las cantidades de hidrógeno y bromo en los productos son el doble de lo que si hay en los reactivos, entonces agregamos el coeficiente 2 al HBr para equilibrar estos dos elementos.
El cloro tiene 3 átomos en los productos y solo 1 en los reactivos, por lo que equilibramos poniendo un coeficiente de 3 antes del HCl.
El hidrógeno tenía 3 átomos en los reactivos y 2 átomos en los productos. Para ajustar las cantidades transformamos el índice H2 en coeficiente, multiplicamos por el 3 que ya estaba en el HCl y obtenemos el resultado de 6HCl.
Ajustamos las cantidades de cloro en los productos para que también tengan 6 átomos y obtengamos 2AlCl3.
El aluminio tenía 2 átomos en los productos, ajustamos la cantidad en los reactivos a 2Al.
Equilibramos la cantidad de hidrógeno en el producto a 3H2 y ajustamos la cantidad de 6 átomos de ese elemento en cada término de la ecuación.
En la ecuación el radical nitrato (NO3-) tiene índice 2 en el producto, transformamos el índice en un coeficiente en el reactivo para 2AgNO3.
Era necesario ajustar la cantidad de plata, ya que ahora tiene 2 átomos en los reactivos, por lo que tenemos 2Ag en el producto.
En los reactivos tenemos 4 átomos de hidrógeno y para equilibrar este elemento agregamos el coeficiente 2 al producto HCl.
El cloro ahora tiene 4 átomos en los productos, por lo que ajustamos la cantidad en el reactivo a 2Cl.2.
Tenemos 6 átomos de hidrógeno en los reactivos y para equilibrar este elemento ajustamos la cantidad de agua a 3H2O.
Tenemos 2 átomos de carbono en los reactivos y para equilibrar este elemento ajustamos la cantidad de dióxido de carbono a 2CO.2.
El oxígeno debe tener 7 átomos en los reactivos y para equilibrar este elemento ajustamos la cantidad de oxígeno molecular a 3O2.
Mirando la ecuación, el radical nitrato (NO3-) tiene índice 2 en el producto. Transformamos el índice en coeficiente 2 en el reactivo AgNO3.
Tenemos 2 átomos de plata en los reactivos y para equilibrar este elemento ajustamos la cantidad de cloruro de plata en el producto a 2AgCl.
Tenemos 3 átomos de calcio en el producto y para equilibrar este elemento ajustamos la cantidad de nitrato de calcio en el reactivo a 3Ca (NO3)2.
Entonces nos quedamos con 6 radicales NO3- en los reactivos y para equilibrar este radical ajustamos la cantidad de ácido nítrico en los productos a 6HNO3.
Ahora tenemos 6 átomos de hidrógeno en los productos y para equilibrar este elemento ajustamos la cantidad de ácido fosfórico en el reactivo a 2H3POLVO4.
Obtenga más información sobre cálculos con ecuaciones químicas en:
- Equilibrio de ecuaciones químicas
- Estequiometria
- Cálculos estequiométricos
- Ejercicios de estequiometría
- Ejercicios de tabla periódica