La ley de Hess fue creada por el químico suizo Germain H. Hess (1802-1850), considerado uno de los fundadores de la termoquímica. Su ley decía:

Es decir, el ΔH depende solo de los valores de entalpía de los reactivos y productos, como en la expresión:
| ΔH = ΔHreactivos + ΔHproductos |
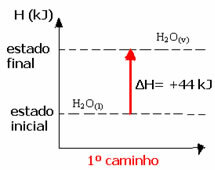
Por ejemplo, considere la reacción en la que 1 mol de agua (H2O) se transforma en agua en estado gaseoso. Esta reacción se realiza dos veces; sin embargo, elegimos diferentes caminos:
(1º) Se realizó en un solo paso:
H2O(1) → H2O(v) ΔH = +44 kJ
(2o) Se llevó a cabo en dos etapas:
1er paso: H2O(1) → H2 (g) + ½ el2 (g) ΔH = +286 kJ
2da etapa: H2 (g) + ½ el2 (g) → H2O(v) ΔH = -242 kJ
H2O(1) → H2O(v) ΔH = +44 kJ
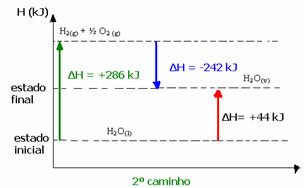
Tenga en cuenta que independientemente de si se han realizado uno o dos pasos, el cambio de entalpía (ΔH) es siempre 44 kJ. Esto se debe a que ΔH es la suma algebraica de los valores de ΔH de los pasos que componen el proceso, es decir, de los procesos intermedios:
| ΔH = ΔH1 + ΔH2 + ΔH3 + ... |
Por ejemplo, en el segundo caso, el ΔH total de la reacción fue la suma del ΔH del primer paso (ΔH = +286 kJ) con el del segundo (ΔH = -242 kJ). Así, obtuvimos el mismo valor de reacción con un solo paso:
ΔH = (+286 + (-242)) kJ
ΔH = (+286-242) kJ
ΔH = +44 kJ
Por tanto, solo nos interesan los valores inicial y final. En este caso, el estado inicial corresponde a H2O(1) y el final de H2O(v).
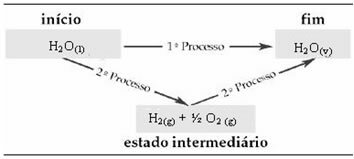
Esta ley se ha vuelto muy importante en termoquímica, porque ciertas reacciones químicas no pueden tener su ΔH determinado experimentalmente. Sin embargo, según la ley de Hess, la entalpía de este tipo de reacción se puede calcular a partir de las entalpías de otras reacciones (reacciones intermedias).
Por Jennifer Fogaça
Licenciada en Química
Equipo Escolar de Brasil

