Las reacciones redox implican la transferencia de electrones entre átomos, iones o moléculas.
En una reacción de oxidación-reducción, ocurren cambios en el número de oxidación (nox). La oxi-reducción consiste en los procesos de oxidación y reducción:
- Oxidación: da como resultado pérdida de electrones y aumento de nox.
- Reducción: da como resultado ganancia de electrones y disminución de nox.
Cuando un elemento cede electrones, otro los recibirá. Por tanto, el número total de electrones recibidos es igual al número total de electrones perdidos.
Ejemplos de reacciones redox a la combustión, corrosión y fotosíntesis.
Ejemplos de
Dependiendo del elemento que recibe o dona electrones, tenemos los siguientes nombres:
- Agente reductor: Aquel que sufre oxidación provoca reducción y aumenta su número de nox. Es lo que pierde electrones.
- Agente oxidante: El que sufre reducción, provoca oxidación y disminuye su número de nox. Es lo que gana electrones.
O número de oxidación representa la carga eléctrica de un elemento en el momento en que participa en un enlace químico.
Esta condición está relacionada con la electronegatividad, que es la tendencia de algunos elementos a recibir electrones.
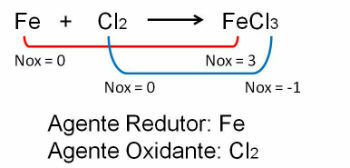
1. Observe el primer ejemplo, observe que en la reacción entre Hierro y Cloro hay un cambio en el número de oxidación. O cloro porque es más electronegativo gana electrones:
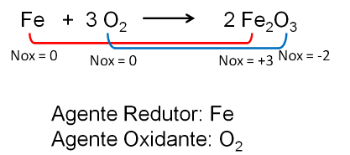
2. Reacción entre hierro y oxígeno. El oxígeno es más electronegativo y termina recibiendo electrones y disminuyendo su número de oxidación.
Obtenga más información, lea también:
- Oxidación
- Combustión
- Reacciones químicas
- electrones
Ejercicio resuelto
1. (PUC-RS) En relación con la ecuación de oxidación - reducción desequilibrada Fe0 + CuSO4 → Fe2(SOLO4)3 + Cu0, se puede decir que:
a) el número de oxidación del cobre en sulfato cúprico es +1.
b) el átomo de hierro pierde 2 electrones.
c) el cobre se oxida.
d) el hierro es un agente oxidante.
e) el hierro sufre oxidación.
Resolución:
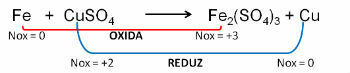
Respuesta:
e) el hierro sufre oxidación.
Ejercicios
1. (UFAC-AC) En la siguiente ecuación química: Zn + 2 HCℓ → ZnCℓ2 + H2
a) el elemento Zn se oxida y reacciona como agente oxidante.
b) el elemento Zn se oxida y reacciona como agente reductor.
c) el elemento Zn se reduce y reacciona como agente reductor.
d) El HCℓ es un agente reductor.
e) la ecuación se clasifica como reversible.
b) el elemento Zn se oxida y reacciona como agente reductor.
2. (ITA-SP) En la reacción iónica Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) el níquel es el oxidante porque se oxida.
b) el níquel es el reductor porque se oxida.
c) el ion cúprico es el oxidante porque se oxida.
d) el ion cúprico es el reductor porque se reduce.
e) no es una reacción redox, por lo tanto no hay oxidante ni reductor.
b) el níquel es el reductor porque se oxida.
3. (UFRGS) El agente activo de la lejía doméstica es el ion hipoclorito, ClO-. En los procesos de blanqueo, este ion se reduce; Esto significa que:
a) la sustancia que sufre la acción del hipoclorito recibe electrones.
b) hay una disminución en el número de electrones en su estructura.
c) ClO- es un agente reductor.
d) ClO- se convierte en cloro elemental o ion cloruro.
e) no se produce ninguna transferencia de electrones.
d) ClO- se convierte en cloro elemental o ion cloruro.


