El calor sensible o el calor específico sensible es una cantidad física que está relacionada con la variación de la temperatura de un cuerpo.
Ejemplo: Calentar una barra de metal
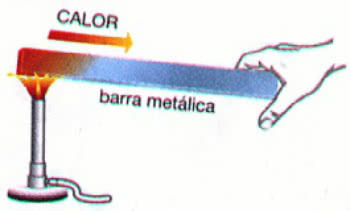
En el ejemplo anterior, el calor se propaga a través del conduccion termica. Este proceso da como resultado un aumento en la temperatura del material, sin embargo, su estado físico permanece igual (sólido).
Fórmula
Para calcular el calor sensible se utiliza la siguiente fórmula:
Q = m. C. Δθ
Q: cantidad de calor sensible (cal o J)
metro: masa corporal (go kg)
C: calor específico de la sustancia (cal / g ° C o J / Kg ° C)
Δθ: variación de temperatura (° C o K)
Nota: Para calcular el calor sensible tenemos que conocer el calor específico que varía en cada sustancia.
Lea mas en: Calor especifico.
Calor sensible y calor latente
En el calor latente (L), el estado físico de la sustancia se modifica, mientras que en calor sensible permanece igual.
Otra diferencia entre los dos está relacionada con la temperatura. Es decir, el calor latente es independiente de la temperatura corporal, mientras que el calor sensible lo considera.
Un ejemplo de calor latente es el derretimiento de un cubo de hielo o la evaporación del agua. En ambos casos, la temperatura en los dos estados físicos sigue siendo la misma.
Para calcular el calor latente, use la siguiente fórmula:
Q = m. L
Dónde,
Q: cantidad de calor (lima o J)
metro: masa (go kg)
L: calor latente (cal / go J / Kg)
Lea también:
- Calor y temperatura
- Calorimetría
- Equilibrio termico
- Capacidad Térmica
- Fórmulas de física
Ejercicios de examen de ingreso con comentarios
1. (Mackenzie) Una fuente de calor suministra calor continuamente, a razón de 150 cal / s, a una masa de agua dada. Si la temperatura del agua aumenta de 20 ° C a 60 ° C en 4 minutos, siendo el agua sensible al calor específico 1.0 cal / g ° C, se puede concluir que la masa de agua calentada, en gramos, es:
a) 500
b) 600
c) 700
d) 800
e) 900
Alternativa y
2. (UFSM-RS) Se coloca un cuerpo de 400 gy calor específico sensible de 0,20 cal / g ° C, a una temperatura de 10 ° C en contacto térmico con otros 200 gy calor específico sensible de 0,10 cal / g ° C, a una temperatura de 60 ° C. La temperatura final, una vez establecido el equilibrio térmico entre los dos cuerpos, será:
a) 14 ° C
b) 15 ° C
c) 20 ° C
d) 30 ° C
e) 40 ° C
Alternativa c
3. (UFPR) Durante el eclipse, en una de las ciudades de la zona de totalidad, Criciúma - SC, hubo un descenso de temperatura de 8.0 ° C. (Horas cero - 04/11/1994)
Sabiendo que el calor específico sensible del agua es 1.0 cal / g ° C, la cantidad de calor liberada por 1000 g de agua, al reducir su temperatura de 8.0 ° C, en cal, es:
a) 8.0
b) 125
c) 4000
d) 8000
e) 64000
Alternativa


