La sublimación es el cambio del estado sólido al estado gaseoso y viceversa, sin pasar por el estado líquido.
Para que una sustancia se someta al proceso de sublimación, debe someterse a ciertos valores de temperatura y presión.
Bolas de naftalina y CO2 sólidos (hielo seco) son ejemplos de sustancias que se someten a sublimación en condiciones ambientales.

Diagrama de fases
Podemos descubrir el estado físico de una sustancia conociendo los valores de temperatura y presión a los que está sometida.
Para ello, utilizamos diagramas construidos para cada sustancia, a partir de valores encontrados experimentalmente.
Llamada "Diagrama de fases", se divide en tres regiones que representan los estados sólido, líquido y gaseoso. Las líneas que delimitan estas regiones señalan los puntos en los que la sustancia cambia de fase.
El punto triple del diagrama indica la temperatura y la presión a las que la sustancia puede coexistir en las tres fases. Debajo de este punto está la curva de sublimación.
Los puntos de esta curva determinan los valores de presión y temperatura a los que se producirá la sublimación.
Cuando un sólido se somete a una presión menor que el punto triple, si se calienta pasará directamente a un estado gaseoso.
El cambio del estado sólido directo al estado gaseoso también puede ocurrir al disminuir la presión cuando su temperatura es más baja que la del punto triple.
Obtenga más información en: Cambios de estado físico.
Diagrama de fases de dióxido de carbono (CO)2 )
El punto triple del CO2 ocurre cuando la presión es de 5 atm. Este hecho justifica que sea común ver la ocurrencia de sublimación en hielo seco, ya que la presión ambiental es de 1 atmósfera.
Por esta razón, no se obtiene dióxido de carbono líquido en condiciones ambientales. En estas condiciones, se encuentra en estado sólido o en estado de vapor.
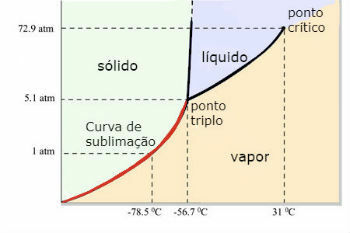
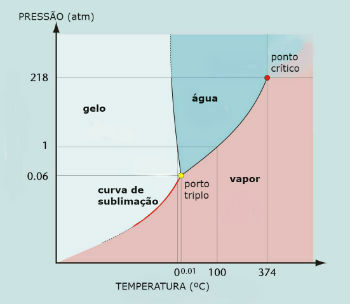
Diagrama de fases del agua (H2O)
El punto triple del agua ocurre cuando la presión es de solo 0.06 atm. Por lo tanto, en condiciones ambientales, la sublimación del agua no es común.
Para obtener más información, lea también:
- Estados físicos del agua
- Estados físicos de la materia
- Licuefacción o Condensación
- Propiedades de la materia
- Solidificación
- Fusión
- Vaporización
- Hirviendo
- Evaporación