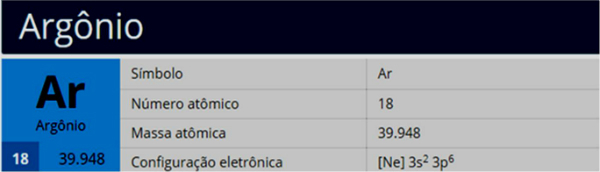
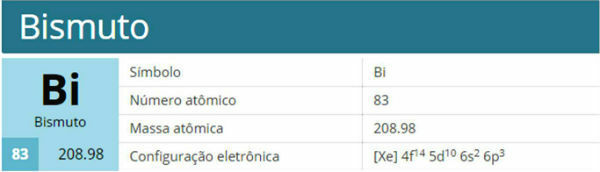
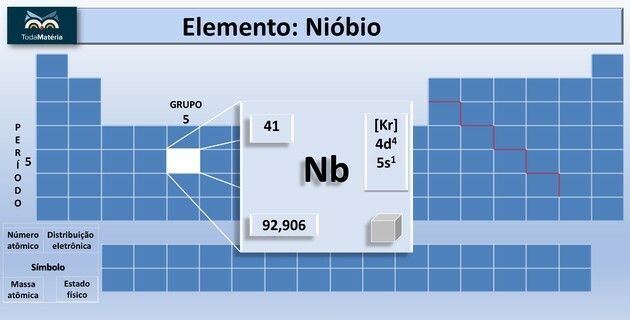
El diagrama de Pauling, también conocido como diagrama de energía, es el representación de la distribución electrónica a través de subniveles de potencia.
A través del esquema, el químico Linus Carl Pauling (1901-1994) sugirió algo más allá de lo que ya se conocía con respecto a la distribución de electrones de los átomos de elementos químicos.
Para mejorar el estado de ánimo, Pauling propuso los subniveles de energía. A través de ellos, sería posible ordenar los electrones desde el nivel de energía más bajo hasta el más alto de un átomo en su estado fundamental.
Distribución electrónica por Linus Pauling
Según el modelo propuesto por Pauling, la electrosfera se divide en 7 capas electrónicas (K, L, M, N, O, P y Q) alrededor del núcleo atómico, cada uno de los cuales permite un número máximo de electrones, que son 2, 8, 18, 32, 32, 18 y 8, respectivamente.
A distribución electrónica la subniveles de energía, mostrando primero el electrón de menor energía hasta alcanzar el electrón de mayor energía.
| Capas Electrónicas | Número máximo de electrones | Subniveles de energía | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 y- | 1 s2 | |||
| 2 | L | 8 y- | 2 s2 | 2p6 | ||
| 3 | METRO | 18 y- | 3 s2 | 3p6 | 3d10 | |
| 4 | norte | 32 y- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 y- | 5 s2 | 5p6 | 5d10 | 5f14 |
| 6 | PAG | 18 y- | 6 s2 | 6p6 | 6d10 | |
| 7 | Q | 8 y- | 7 s2 | 7p6 |
La capa K tiene solo un subnivel (s), la capa L tiene dos subniveles (syp), la capa m tiene tres subniveles (s, pyd) y así respectivamente.
Los subniveles s permiten hasta 2 electrones, mientras que los subniveles p permiten hasta 6 electrones. A continuación, los subniveles d permiten hasta 10 electrones, mientras que los subniveles f permiten hasta 14 electrones.
Tenga en cuenta que la suma de los electrones que se comportan en cada subnivel por capa de electrones da como resultado el número máximo de electrones en cada una de las 7 capas.
K: s2 = 2
L y Q: s2 + p6 = 8
M y P: s2 + p6 + d10 = 18
N y O: y2 + p6 + d10 + f14= 32
Fue entonces cuando Pauling descubrió la orden creciente de energía:
1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 5 s2 4d10 5p6 6 s2 4f14 5d10 6p6 7 s2 5f14 6d10 7p6
A partir de ahí aparecen las flechas diagonales en el diagrama para hacer la distribución electrónica de los elementos:
 Diagrama de Pauling
Diagrama de Pauling
Ejemplo de distribución electrónica de fósforo 15PAG:
1 s2 2 s2 2p6 3 s2 3p3
como hasta 3 s2 ya teníamos un total de 12 electrones (2 + 2 + 6 + 2), solo necesitamos 3 electrones más del subnivel 3p6.
Así, podemos obtener la cantidad requerida de electrones, siempre que no sea mayor que 6, que es el número máximo que el subnivel 3p6 se comporta.
Leer tambien Capa de Valencia y Números cuánticos.
Ejercicios resueltos sobre distribución electrónica
Pregunta 1
(Unirio) “Los implantes dentales son más seguros en Brasil y ya cumplen con los estándares internacionales de calidad. El gran salto de calidad se produjo en el proceso de fabricación de tornillos y pasadores de titanio, que componen las prótesis. Fabricadas con aleaciones de titanio, estas prótesis se utilizan para fijar coronas dentales, aparatos de ortodoncia y dentaduras postizas en los huesos de la mandíbula y la mandíbula ”. (Jornal do Brasil, octubre de 1996.)
Teniendo en cuenta que el número atómico del titanio es 22, su configuración electrónica será:
a) 1 s2 2 s2 2p6 3 s2 3p3
b) 1 s2 2 s2 2p6 3 s2 3p5
c) 1 s2 2 s2 2p6 3 s2 3p6 4s2
d) 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d2
e) 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6
Alternativa correcta: d) 1s2 2 s2 2p6 3 s2 3p6 4s2 3d2.
El diagrama de Linus Pauling para la distribución de electrones en titanio es:
Pregunta 2
(ACAFE) Considerando cualquier elemento M genérico, que tiene configuración electrónica 1s2 2 s2 2p6 3 s2 3p6 4s2 3d5, se puede decir que:
I. su número atómico es 25;
II. tiene 7 electrones en la última capa;
III. tiene 5 electrones desapareados;
IV. pertenecen a la familia 7A.
Las declaraciones son correctas:
a) Solo I, II y III
b) Solo I y III
c) II y IV solamente
d) Solo I y IV
e) II, III y IV solamente
Alternativa correcta: b) Solo I y III.
I. CORRECTO Contando el número de electrones en la distribución electrónica vemos que se utilizaron 25. Por tanto, el número atómico es 25 y corresponde al elemento químico manganeso.
II. EQUIVOCADO. La última capa, es decir, la capa más externa tiene 2 electrones, siendo los 4s2.
III. CORRECTO Los electrones no apareados están en el subnivel d, que contiene hasta 10 electrones, pero en la distribución electrónica del manganeso solo se han asignado 5 electrones al subnivel.
IV. EQUIVOCADO. El manganeso se encuentra en la familia 7B y en el cuarto período.
Pregunta 3
(UFSC) El número de electrones en cada subnivel del átomo de estroncio (38Sr) en orden ascendente de energía es:
a) 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 5 s2
b) 1 s2 2 s2 2p6 3 s2 3p6 4s2 4p6 3d10 5 s2
c) 1 s2 2 s2 2p6 3 s2 3p6 3d10 4s2 4p6 5 s2
d) 1 s2 2 s2 2p6 3 s2 3p6 4p6 4s2 3d10 5 s2
e) 1 s2 2 s2 2p6 3p6 3 s2 4s2 4p6 3d10 5 s2
Alternativa correcta: a) 1s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 5 s2.
El diagrama de Linus Pauling para la distribución de electrones de estroncio es:
¡Pon a prueba tus conocimientos aún más! También resuelve:
- Ejercicios de distribución electrónica
- Ejercicios de la tabla periódica