El niobio (Nb) es el elemento químico de número atómico 41 que pertenece al grupo 5 de la tabla periódica.
Es un metal de transición disponible de forma natural en estado sólido, que fue descubierto en 1801 por el químico británico Charles Hatchett.
Los minerales que contienen niobio son raros en el mundo, pero abundantes en Brasil, el país con mayores reservas de este metal.
Debido a sus propiedades, alta conductividad y resistencia a la corrosión, este elemento tiene muchas aplicaciones que van desde la producción de acero hasta la fabricación de cohetes.
A continuación, presentaremos este elemento químico y las características que lo hacen tan importante.

¿Qué es el niobio?
El niobio es un metal refractario, es decir, es muy resistente al calor y al desgaste.
Los metales de esta clase son: niobio, tungsteno, molibdeno, tantalio y renio, siendo el niobio el más ligero de todos.
El niobio se encuentra en la naturaleza en minerales, generalmente ligados a otros elementos, principalmente tantalio, ya que ambos tienen propiedades fisicoquímicas muy similares.
Este elemento químico está clasificado como un metal de transición en la tabla periódica. Es brillante, de baja dureza, con baja resistencia al paso de la corriente eléctrica y resistente a la corrosión.
Propiedades físicas del niobio
| estado fisico | sólido a temperatura ambiente |
|---|---|
| color y apariencia | gris metalizado |
| Densidad | 8.570 g / cm33 |
| Punto de fusión | 2468 ° C |
| Punto de ebullición | 4742 ° C |
| Estructura cristalina | Cúbico centrado en el cuerpo - CCC |
conductividad térmica |
54,2 W · m-1 K-1 |
Propiedades químicas del niobio
| Clasificación | metal de transición |
|---|---|
| número atómico | 41 |
| Cuadra | D |
| Grupo | 5 |
| Curso del tiempo | 5 |
| peso atomico | 92,90638 u |
| rayo atómico | 1,429 Å |
| iones comunes | Nótese bien5+ y Nb3+ |
| electronegatividad | 1.6 Pauling |
La principal ventaja de usar este metal es que solo una cantidad, en gramos, de este elemento puede modificar una tonelada de hierro, haciendo que el metal sea más liviano, resistente a la corrosión y más eficiente.
¿Dónde se encuentra el niobio?
En comparación con otras sustancias presentes en la naturaleza, el niobio tiene una concentración baja, en la proporción de 24 partes por millón.
Este metal se encuentra en los siguientes países: Brasil, Canadá, Australia, Egipto, República Democrática del Congo, Groenlandia, Rusia, Finlandia, Gabón y Tanzania.
Niobio en Brasil
En la década de 1950, el geólogo brasileño Djalma Guimarães descubrió en Brasil el depósito más grande de mineral pirocloro que contenía este metal.
La gran cantidad de minerales que contienen niobio se encuentra en Brasil, el mayor productor del mundo, que posee más del 90% de las reservas del metal.
Las reservas exploradas están ubicadas en los estados de Minas Gerais, Amazonas, Goiás y Rondônia.
minerales de niobio
El niobio se encuentra en la naturaleza siempre ligado a otros elementos químicos. Ya se conocen más de 90 especies minerales que contienen niobio y tantalio en la naturaleza.
En la siguiente tabla podemos ver algunos de los minerales que contienen niobio, las principales características y el contenido de niobio disponible en cada material.
| tantalita columbita | |
|---|---|
 | |
| Composición: | (Fe, Mn) (Nb, Ta)2O6 |
| Contenido de niobio (máximo): | 76% de Nb2O5 |
| Características: |
|
| Piroclorito | |
|---|---|
 | |
| Composición: | (A2,Aquí)2(Nb, Ti) (O, F)7 |
| Contenido de niobio (máximo): | 71% de Nb2O5 |
| Características: |
|
| Loparita | |
|---|---|
 | |
| Composición: | (C, Na, C)2(Ti, Nb)2O6 |
| Contenido de niobio (máximo): | 20% de Nb2O5 |
| Características: |
|
exploración de niobio
Los minerales de niobio experimentan transformaciones hasta que se forman los productos que se comercializarán.
Los pasos del proceso se pueden resumir como:
- Minería
- Concentración de niobio
- Refinación de niobio
- Productos de niobio
La minería se realiza donde existen reservas de mineral, que se extraen mediante explosivos y se transportan por cinturones hasta donde se lleva a cabo la etapa de concentración.
La concentración ocurre con la descomposición del mineral, la molienda hace que los cristales del mineral se vuelvan mucho más finos y el uso de la Separación magnética las fracciones de hierro se eliminan del mineral.
En el refinado del niobio, se elimina el azufre, el agua, el fósforo y el plomo.
Uno de los productos que contienen niobio es la aleación de hierro-niobio, que se produce de acuerdo con la siguiente ecuación:
Este proceso se llama aluminotermia en el que el concentrado de mineral se mezcla en reactores con chatarra de hierro u óxido de hierro.
Los óxidos metálicos reaccionan con el aluminio a altas temperaturas, generando el producto de interés.
Los productos de niobio más comercializados son:
- Concentrados de niobio: una base que contiene un 58% de Nb2O5.
- Aleación de hierro-niobio: contiene un 65% de niobio.
- Óxido de alta pureza: utilizado en la producción de materiales especiales.
¿Para que sirve el niobio?
Las características del niobio hacen que este elemento sea cada vez más deseable y con innumerables aplicaciones.
Desde su descubrimiento en 1905, se comenzaron a investigar las aplicaciones del niobio, cuando el químico alemán Werner von Bolton produjo el elemento en forma pura.
Los años 50 supusieron una gran búsqueda de aplicaciones del niobio, ya que hasta entonces no se producía a gran escala.
Durante este período, la guerra fría despertó el interés en este metal para ser utilizado en componentes aeroespaciales.
A continuación se muestra una lista de las formas en que se usa el niobio.
Aleaciones de metales

La adición de niobio a una aleación aumenta su templabilidad, es decir, la capacidad de endurecerse cuando se expone al calor y luego se enfría. Por tanto, el material que contiene niobio puede someterse a tratamientos térmicos específicos.
La afinidad del niobio con el carbono y el nitrógeno favorece las propiedades mecánicas de la aleación, aumentando, por ejemplo, la resistencia mecánica y la resistencia al desgaste abrasivo.
Estos efectos son beneficiosos ya que pueden ampliar las aplicaciones industriales de una aleación.
El acero, por ejemplo, es una aleación metálica formada por hierro y carbono. La adición de niobio a esta aleación puede tener ventajas para:
- Industria automotriz: producción de un coche más ligero y resistente a las colisiones.
- Construcción civil: mejora la soldabilidad del acero y aporta maleabilidad.
- Industria de oleoductos de transporte: Permite construcciones con paredes más delgadas y diámetros mayores, sin afectar la seguridad.
súper aleaciones

La superaleación es una aleación metálica con alta resistencia a altas temperaturas y resistencia mecánica. Las aleaciones que contienen niobio hacen que este material sea útil en la fabricación de turbinas de aviones o en la producción de energía.
La ventaja de operar a altas temperaturas hace que las superaleaciones compongan motores a reacción de alto rendimiento.
imanes superconductores

La superconductividad del niobio hace que los compuestos de niobio-germanio, niobio-escandio y niobio-titanio se utilicen en:
- Escáner de máquinas de resonancia magnética.
- Aceleradores de partículas como el Gran Colisionador de Hadrones.
- Detección de radiación electromagnética y estudio de radiación cósmica por materiales que contienen nitrito de niobio.
Óxidos
Otras aplicaciones del niobio se encuentran en forma de óxidos, principalmente Nb2O5. Los principales usos son:
- Lentes ópticos
- Condensadores cerámicos
- sensores de pH
- partes del motor
- Joyas
Historia y descubrimiento del niobio
En 1734, algunos minerales pertenecientes a una colección personal de John Winthrop fueron llevados de América a Inglaterra y estos elementos formaban parte de la colección del Museo Británico de Londres.
Al unirse a la Royal Society, el químico británico Charles Hatchett se centró en investigar la composición de los minerales disponibles en el museo. Es así como, en 1801, aisló un elemento químico, en forma de óxido, y lo denominó columbio y el mineral del que se extrajo columbita.
En 1802, el químico sueco Anders Gustaf Ekeberg informó del descubrimiento de un nuevo elemento químico y lo llamó tantalio, en referencia al hijo de Zeus en la mitología griega.
En 1809, el químico y físico inglés William Hyde Wollaston analizó estos dos elementos y observó que tenían características muy similares.
Debido a este hecho, de 1809 a 1846, el columbio y el tantalio se consideraron el mismo elemento.
Más tarde, el mineralogista y químico alemán Heinrich Rose, investigando el mineral de columbita, notó que el tantalio también estaba presente.
Rose encontró la presencia de otro elemento, similar al tantalio y lo llamó Niobius, en referencia a Niobe, hija de Tantalus, de la mitología griega.
En 1864, el sueco Christian Bromstrand logró aislar el niobio de una muestra de cloruro calentada en una atmósfera de hidrógeno.
En 1950, la Unión de Química Pura y Aplicada (IUPAC) aprobó el niobio como nombre oficial, en lugar de columbio, ya que eran el mismo elemento químico.
Resumen de niobio
Elemento químico: niobio | |||
|---|---|---|---|
| Símbolo | Nótese bien | Descubridor | Charles Hatchett |
| número atómico | 41 | masa atomica | 92.906 u |
| Grupo | 5 | Curso del tiempo | 5 |
| Clasificación | metal de transición | Distribución electrónica | [Kr] 4d35 s2 |
| Características |
|
||
| Minerales principales |
|
||
| Productos principales |
|
||
| aplicaciones |
|
||
| Ocurrencia | En el mundo |
|
|
| En Brasil |
|
Ejercicios de enem y exámenes de acceso
1. (Enem / 2018) En la mitología griega, Niobia era la hija de Tantalus, dos personajes conocidos por su sufrimiento. El elemento químico con número atómico (Z) igual a 41 tiene propiedades químicas y físicas tan similares al elemento con número atómico 73 que se confundieron.
Por lo tanto, en honor a estos dos personajes de la mitología griega, estos elementos recibieron los nombres de niobio (Z = 41) y tantalio (Z = 73). Estos dos elementos químicos han adquirido una gran importancia económica en la metalurgia, en la producción de superconductores y en otras aplicaciones industriales de alta gama, precisamente debido a las propiedades químicas y físicas común a ambos.
KEAN, S. La cuchara que desaparece: y otras historias reales de locura, amor y muerte por elementos químicos. Río de Janeiro: Zahar, 2011 (adaptado).
La importancia económica y tecnológica de estos elementos, por la similitud de sus propiedades químicas y físicas, se debe a
a) tienen electrones en el subnivel f.
b) ser elementos de transición interna.
c) pertenecen al mismo grupo en la tabla periódica.
d) tienen sus electrones más externos en los niveles 4 y 5, respectivamente.
e) estar ubicados en la familia de los alcalinotérreos y alcalinos, respectivamente.
Alternativa correcta: c) pertenecen al mismo grupo en la tabla periódica.
La tabla periódica está organizada en 18 grupos (familias), donde cada grupo reúne elementos químicos con propiedades similares.
Estas similitudes ocurren porque los elementos de un grupo tienen el mismo número de electrones en la capa de valencia.
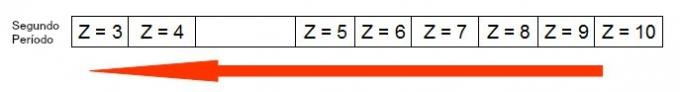
Haciendo la distribución electrónica y sumando los electrones del subnivel más energético al subnivel más externo encontramos el grupo al que pertenecen los dos elementos.
| Niobio | |
|
Distribución electrónica |
1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p65 s2 4d3 |
|
la suma de electrones |
más enérgico + más externo 4d3 + 5s2 = 5 electrones |
| Grupo | 5 |
| Tantalio | |
|
Distribución electrónica |
1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 5 s2 4d10 5p66 s2 4f145d3 |
|
la suma de electrones |
más enérgico + más externo 5d3 + 6s2 = 5 electrones |
| Grupo | 5 |
Los elementos niobio y tantalio:
- Pertenecen al mismo grupo en la tabla periódica.
- Tienen sus electrones más externos en los niveles 5 y 6, respectivamente, por lo que se ubican en el quinto y sexto período.
- Tienen electrones en el subnivel d y, por tanto, son elementos de transición en el exterior.
2. (IFPE / 2018) Brasil es el mayor productor mundial de niobio, representando más del 90% de la reserva de este metal. El niobio, símbolo Nb, se utiliza en la producción de aceros especiales y es uno de los metales más resistentes a la corrosión y temperaturas extremas. El compuesto Nb2O5 es el precursor de casi todas las aleaciones y compuestos de niobio. Marque la alternativa con la masa requerida de Nb2O5 para obtener 465 gramos de niobio. Dado: Nb = 93 g / mol y O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Alternativa correcta: e) 665 g
El compuesto precursor del niobio es el óxido de Nb.2O5 y el niobio utilizado en las aleaciones está en forma de Nb elemental.
Por tanto, tenemos la siguiente relación estequiométrica:
1 mol de Nb2O5 genera 2 moles de Nb, ya que el óxido de niobio está formado por 2 átomos de este metal.
1er paso: calcular el número de moles de niobio producido que corresponde a 465 g.
Si por el cálculo vimos que la masa de niobio corresponde a 5 moles, entonces la cantidad de moles de Nb2O5 utilizado es la mitad de este valor, porque:
2º paso: calcular la masa molar del óxido de niobio.
3er paso: calcular la masa de óxido de niobio que corresponde a 2,5 moles.
3. (UECE / 2015) Brasil posee el 98% de las reservas mundiales de niobio, lo que tiene numerosas aplicaciones industriales como, por ejemplo, en la fabricación de joyas, implantes hiperalérgicos, electrocerámicas, imanes superconductores, máquinas de resonancia magnética, aleaciones metálicas, monedas especiales y en la producción de acero. Para el niobio, revise las declaraciones a continuación y marque la única alternativa verdadera.
a) Su electrón diferencial se encuentra en la penúltima capa.
b) Es un elemento representativo.
c) Su electronegatividad es menor que la del vanadio.
d) Pertenece al cuarto período de la tabla periódica.
Alternativa correcta: a) Su electrón diferencial se encuentra en la penúltima capa.
Al realizar la distribución electrónica del niobio, es posible ver que su electrón diferencial se ubica en la penúltima capa.
Debido a que tiene el electrón diferencial en el subnivel d, es un elemento de transición externo.
Dado que su nivel más externo está en la quinta capa, el niobio se encuentra en el quinto período de la tabla.
La electronegatividad es la propiedad relacionada con la capacidad del elemento para atraer electrones y varía según la radio atómico: cuanto menor es el radio atómico, mayor es la atracción por los electrones y, por lo tanto, mayor es la electronegatividad.
Consultando la tabla con los valores de electronegatividad, es posible ver que el niobio y el vanadio tienen valores cercanos a 1.6 Pauling.
4. (UEA / 2014) El isótopo natural del niobio es el 93Nótese bien. El número de neutrones en este isótopo es
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Alternativa correcta: b) 52.
Los isótopos son átomos de un elemento químico con diferentes números de masa.
La masa atómica corresponde a la suma de los protones y neutrones de un elemento.
El número de protones representa el número atómico del elemento químico y para los isótopos no cambia.
Por tanto, la variación de masa de los isótopos se produce debido al diferente número de neutrones.
Si el número atómico del niobio es 41, entonces el número de neutrones viene dado por el cálculo:
5. (IFMG / 2015) El elemento químico niobio, Nb, lleva el nombre de la diosa griega Niobe. Brasil es el mayor productor mundial del metal y representa el 75% de la producción. Debido a la estabilidad térmica de sus aleaciones, el niobio se utiliza en la producción de aleaciones especiales de acero de alta resistencia para motores, equipos de propulsión y diversos materiales superconductores. Al observar la posición del niobio en la tabla periódica, es correcto afirmar que:
a) su subnivel más energético será el subnivel d.
b) es un elemento perteneciente a la familia de los metales alcalinos.
c) forma compuestos iónicos con otros metales.
d) sus cationes tendrán un radio atómico mayor que el elemento puro.
Alternativa correcta: a) su subnivel más energético será el subnivel d.
Al observar la tabla periódica podemos ver que el niobio se caracteriza como un elemento de transición exterior, que pertenece al grupo 5 de la tabla periódica, ya que su subnivel más energético es d.
También podemos obtener esta información distribuyéndola electrónicamente.
Como es un metal, este elemento hace conexiones metálicas con otros metales, como en la aleación. hierro-niobio o también enlaces covalentes, al compartir electrones, como en el óxido de niobio Nótese bien2O5.
6. (UFSC / 2003) El niobio fue descubierto en 1801 por el químico inglés Charles Hatchett. Brasil posee alrededor del 93% de la producción mundial de concentrado de niobio. Los mayores depósitos se encuentran en los estados de Minas Gerais, Goiás y Amazonas. El metal se utiliza principalmente en la fabricación de aleaciones de hierro-niobio y otras aleaciones más complejas, que se han aplicado en la construcción de turbinas de propulsión a chorro, cohetes y naves espaciales. Sus óxidos se utilizan en la fabricación de lentes de luz para anteojos, cámaras fotográficas y otros equipos ópticos. Dado (Z = 41). Con respecto al niobio, marque las proposiciones CORRECTAS.
(01) El niobio, al perder 3 electrones, asume la configuración de criptón.
(02) El niobio puede formar óxidos metálicos de tipo M2O5 en2O3.
(04) El símbolo químico del niobio es Ni.
(08) El niobio es un metal de transición.
(16) Una aleación de hierro-niobio es un ejemplo de solución sólida.
Alternativas correctas: 02 + 08 + 16 = 26.
(01) INCORRECTO.
| Elementos | Distribución electrónica |
| 36Kr | 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 |
|
41Nótese bien 41Nótese bien3+ |
1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 5 s2 4d3 1 s2 2 s2 2p6 3 s2 3p6 4s2 3d10 4p6 4p6 4d2 |
(02) CORRECTO
Teniendo en cuenta los números de oxidación 3+ y 5+ del niobio, puede formar los compuestos:
| Número de oxidación 5+ | Número de oxidación 3+ |
| Nótese bien2O5 | Nótese bien2O3 |
(04) INCORRECTO
Ni es el símbolo del elemento níquel. El símbolo del niobio es Nb.
(08) CORRECTO
El niobio es un metal de transición externo que pertenece al grupo 5 de la tabla periódica.
(16) CORRECTO
Una solución sólida corresponde a una mezcla de dos o más componentes en una misma fase, que es sólida, siendo común entre los metales.
7. (UERJ / 2013) El niobio es un metal que se encuentra en depósitos naturales, principalmente en forma de óxidos.
En un depósito que contiene niobio con un número de oxidación +5, la fórmula del óxido predominante de este metal corresponde a:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Alternativa correcta: d) Nb2O5
El oxígeno forma dos enlaces y tiene un número de oxidación fijo, que es 2-.
Por lo tanto, para formar óxido de niobio, el oxígeno debe unirse a 2 átomos de este metal.
El niobio tiene diferentes estados de oxidación. Con el número de oxidación 3+ se une a 3 oxígenos y con Nox 5+ forma el compuesto: Nb2O5 donde 2 átomos de niobio se unen con 5 átomos de oxígeno.

Lea el texto para responder las preguntas 8 a 10.
El niobio es un metal de gran importancia tecnológica y sus principales reservas mundiales se encuentran en el
Brasil, en forma de mineral pirocloro, compuesto por Nb2O5. En uno de los procesos de su metalurgia extractiva, se utiliza aluminotermia en presencia de óxido de Fe2O3, dando como resultado una aleación de niobio y óxido de hierro y aluminio como subproducto. La reacción de este proceso se representa en la ecuación:
En la naturaleza, el niobio aparece en forma del isótopo estable niobio-93, pero se conocen varios isótopos sintéticos inestables que se descomponen por emisión de radiación. Uno de ellos es el niobio-95 que se descompone en el elemento molibdeno-95.
(Systems.dnpm.gov.br; Tecnología Metal. Mater. Miner., São Paulo, v. 6, no. 4, pág. 185-191, abril-junio. 2010 y G. Audi et al./Nuclear Physics A 729 (2003) 3–128. Adaptado)
8. (FGV / 2019) En la reacción de aluminotermia para obtener la aleación de niobio y hierro, considerando la estequiometría presentada en la ecuación balanceada, el número total de electrones involucrados en el proceso es
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Alternativa correcta: e) 36.
La reacción redox ocurre con la pérdida y ganancia de electrones.
Cuando un elemento se reduce gana electrones y cuando se oxida un elemento pierde electrones.
Cuando un elemento se reduce es un agente oxidante, mientras que cuando un elemento se oxida es un agente reductor.
De esta forma, el número de electrones que perdió un elemento y se entregó a otro es igual.
| Elemento | NOX | Reacción | electrones | |
| Niobio |
+5 3Nótese bien2O5 |
0 6Nb |
Reducción | 3.2.5 = 30 y- ganancias |
| Hierro |
+3 Fe2O3 |
0 2Fe |
Reducción | 2,3 = 6 y- ganancias |
| Aluminio |
0 12Alabama |
+3 6Al2O3 |
Oxidación | 6.2.3 = 36 y- perdió |
La carga de aluminio en el producto de óxido de aluminio es 3+, es decir, cada aluminio ha perdido 3 electrones.
Pero en los productos tenemos 12 átomos de aluminio, lo que hace que el número total de electrones involucrados en el proceso:
12. 3 = 36 electrones.
9. (FGV / 2019) En una operación aluminotérmica para la producción de niobio y aleación de hierro con cantidades estequiométricas de Nb2O5 y Fe2O3 y el uso de exceso de aluminio metálico, se formaron 6,12 toneladas de Al.2O3. La suma total de las cantidades, en moles, de niobio y hierro que se estima obtener en esta operación es
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Alternativa correcta: d) 8 × 104.
1er paso: calcular la masa molar de Al2O3
2do paso: calcular el número de moles de Al2O3
3er paso: realizar las relaciones estequiométricas.
En la ecuación química, vemos que existe la relación: 6 moles de niobio, 6 moles de aluminio y 2 moles de hierro.
Por la razón del número de moles formados, tenemos:
Y la suma de las cantidades de niobio y hierro, en moles, es:

En el proceso de desintegración de radioisótopos de niobio-95, el tiempo que tarda la actividad de esta muestra en desintegrarse a 25 MBq y el nombre de la especie emitida son
a) 140 días y neutrones.
b) 140 días y protones.
c) 120 días y protones.
d) 120 días y partículas ß–.
e) 140 días y partículas ß–.
Alternativa correcta: e) 140 días y partículas ß–.
La vida media es el tiempo que tarda una muestra radiactiva en reducir a la mitad su actividad.
En el gráfico vemos que la actividad radiactiva comienza en 400 MBq, por lo que la vida media es el tiempo que tardó la actividad en decaer a 200 MBq, que es la mitad de la inicial.
Analizamos en la gráfica que este tiempo fue de 35 días.
Para que la actividad volviera a caer a la mitad, pasaron otros 35 días y la actividad pasó de 200 MBq a 100 MBq cuando pasaron otros 35 días, es decir, de 400 a 100 MBq pasaron 70 días.
Para que la muestra se pudriera hasta 25 MBq, se requirieron 4 tiempos de semivida.
Que corresponde a:
4 x 35 días = 140 días
En la desintegración radiactiva, las emisiones pueden ser alfa, beta o gamma.
La radiación gamma es una onda electromagnética.
La emisión alfa tiene una carga positiva y disminuye 4 unidades en masa y 2 unidades en el número atómico del elemento decaído, convirtiéndolo en otro elemento.
La emisión beta es un electrón de alta velocidad que aumenta el número atómico del elemento decaído en una unidad, convirtiéndolo en otro elemento.
El niobio-95 y el molibdeno-95 tienen la misma masa, por lo que se produjo una emisión beta porque: