Se sabe desde hace mucho tiempo que cuando la luz solar pasa a través de un prisma, similar al de la figura anterior, se produce la dispersión de los componentes de la luz. Este conjunto de colores que van del rojo al violeta se conoce como espectro continuo, ya que la transición de un color a otro es prácticamente imperceptible.
Estos colores componen lo que llamamos el luz visible o radiación visible, que se componen de ondas electromagnéticas. O sea, ondas formadas por oscilaciones en el campo eléctrico y el campo magnético que ocurren simultáneamente, siendo perpendiculares entre sí.
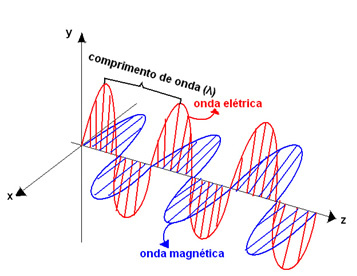
Estas olas tienen frecuencias (f) - número de vibraciones de esta onda por segundo - y longitud de onda - la distancia de la cresta de una ola a la otra, representada por la letra griega lambda (λ). Por tanto, la diferencia entre un color y otro es la frecuencia y longitud de onda de cada onda electromagnética que compone los colores.
Sin embargo, este fenómeno de observación del espectro no solo se obtiene con la luz solar. También podemos hacer que otras luces pasen por un prisma. Entonces obtendremos otros espectros. Sin embargo, estos
espectros estarán discontinuo, con espaciado entre colores, que llamamos en el espectro como manchas o bandas.Digamos, por ejemplo, que dejamos pasar la luz emitida por un tubo de descarga de gas, lleno de gas hidrógeno, a través de un prisma. El espectro obtenido sería similar al que se muestra a continuación.

Si fuera el gas de otro elemento, el espectro también sería discontinuo, pero se vería diferente. De esta forma, cada espectro sirve como un “digital” para la identificación de elementos químicos; porque cada uno tiene un espectro diferente; nunca se repite.
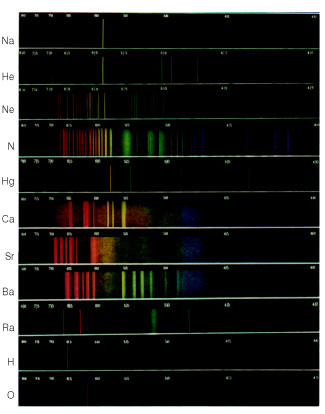
Hoy en día es posible obtener y visualizar los espectros de los elementos a través de un dispositivo llamado espectroscopio.
Por Jennifer Fogaça
Licenciada en Química
Fuente: Escuela Brasil - https://brasilescola.uol.com.br/quimica/espectro-eletromagnetico-dos-elementos-quimicos.htm