En muchos medicamentos y productos alimenticios líquidos y sólidos, como el vinagre y las galletas, por ejemplo, el contenido en porcentaje de masa del soluto (m1) en relación con la masa de toda la solución (m = m1 + m2). Esta magnitud se llama Título (T) o porcentaje de masa de una solución.
Su definición se puede expresar de la siguiente manera:

Así, su cálculo se realiza mediante la siguiente ecuación matemática:
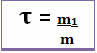
o

Dado que tanto el denominador como el numerador se refieren a la misma unidad (la unidad de masa es el gramo - g), el título no tiene unidad y es menor que 1.
Así, si decimos que el título de una solución dada es 0.4, significa que por cada unidad de masa de la solución, 0.4 corresponde a la masa del soluto. Sin embargo, el título a menudo se expresa como un porcentaje. Para hacer esto, simplemente multiplique el valor encontrado por 100%. En este caso se llama Porcentaje de masa (T%) *
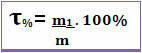
Observe la siguiente figura, en la que se da el porcentaje en masa de cloruro de sodio en una solución salina:

La solución salina, utilizada en el tratamiento de la deshidratación, contiene un porcentaje en masa de cloruro de sodio del 0,9%.
No pares ahora... Hay más después de la publicidad;)
En este caso, significa que por cada 100 go 100 unidades de esta solución, hay 0,9 go 0,9% de soluto, es decir, de cloruro de sodio (NaCl - sal de mesa).
Otro ejemplo es el vinagre: en su etiqueta hay una indicación de que en su preparación se utilizó el 5% de la masa de ácido acético, es decir, hay 5 g de este ácido por cada 100 g de solución.

El título también se puede dar en porcentaje de volumen. En este caso, la única diferencia es que en lugar de relacionar la masa del soluto con la masa de la solución; el volumen del soluto está relacionado con el volumen de la solución, de acuerdo con la siguiente fórmula:
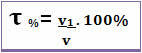
Por ejemplo, en el caso del alcohol regular, que tiene un porcentaje en volumen de 96%, en 100 mL de solución, 96 mL es alcohol.

* El término “Título” se usa más entre los científicos, mientras que los técnicos y varios autores de libros usan la expresión “Porcentaje de masa” con más frecuencia.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Título o porcentaje de masa"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm. Consultado el 28 de junio de 2021.

