Considere la reacción reversible genérica a continuación, donde las letras minúsculas corresponden a los coeficientes de reacción balanceados y las letras mayúsculas son los reactivos y los productos son todos gaseosos:

Considerando cada una de las direcciones de reacción por separado, sus tasas de desarrollo (Td) vienen dadas por:
* Reacción directa: aA + bB → cC + dD
Todasdirecto = Kdirecto. [LA]La. [B]B
* Reacción inversa: cC + dD → aA + bB
Todasinverso = Kcontrarrestar. [C]C. [D]D
La constante de equilibrio químico en términos de concentración en cantidad de materia (KC) y en términos de presión parcial (KPAG) se obtendrá dividiendo Kdirecto por Kcontrarrestar.
Entonces tenemos:
Kdirecto. [LA]La. [B]B = 1 → Kdirecto__ = __[C]C. [D]D___
Kcontrarrestar. [C]C. [D]D Kcontrarrestar [LA]La. [B]B
Siendo, KC =_Kdirecto_
Kcontrarrestar
Entonces tenemos:
KC =__[C]C. [D]D___ o KPAG =__(Plaza)C. (pD)D___ |
Donde p es la presión parcial de cada sustancia en equilibrio.
De esta manera, cada concentración se eleva a un exponente correspondiente al coeficiente de la sustancia respectiva en la reacción, y K
C no tiene unidad *.Además, un aspecto muy importante a destacar es que en esta expresiónno se deben representar ni componentes sólidos ni líquidos puros., ya que sólo las materias que pueden sufrir variación participan en esta expresión. La concentración en cantidad de materia de una sustancia en estado sólido es constante y, por lo tanto, ya está incluida en el valor de K mismo.C. Lo mismo ocurre con los líquidos puros como el agua. En breve, sólo las sustancias en estado gaseoso y en solución acuosa participan en la expresión.
No pares ahora... Hay más después de la publicidad;)
Tenga en cuenta los ejemplos siguientes:
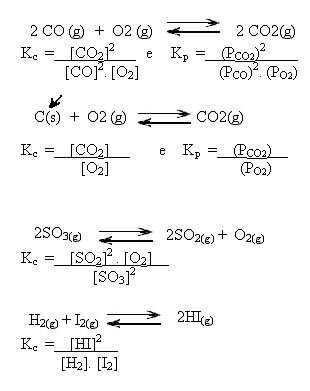
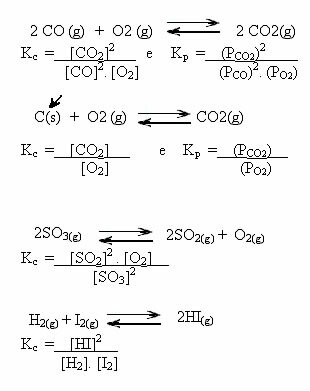
Valores KC nos puede mostrar si la concentración de reactivos y productos es la misma o si uno es mayor que el otro:
- Si KC o KPAG es igual a uno (KC = 1), esto significa que la concentración de reactivos y productos es igual;
- si el valor de KC o KPAG ser alto, esto significa que los productos están en mayor concentración, porque en la expresión de KC los productos están en el numerador;
- si el valor de KC o KPAG es bajo, esto significa que los reactivos están en mayor concentración, porque en la expresión de KC los reactivos están en el denominador.
* KC y KPAG son números adimensionales, es decir, números puros, sin unidad relacionada con ninguna magnitud o relación entre magnitudes.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Constantes de equilibrio Kc y Kp"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Consultado el 28 de junio de 2021.