Cuando decimos la palabra “equilibrio” nos viene a la mente un objeto que permanece indefinidamente. Sin embargo, este es solo un tipo de equilibrio, llamado "equilibrio estático".
También está el "equilibrio dinámico". En él, como dice el nombre, no hay un solo momento en el que el objeto o fenómeno en cuestión esté quieto. Por ejemplo, para que lo entienda, vea la ilustración a continuación y observe que la cantidad de agua que cae dentro del recipiente es igual a la cantidad que sale de él, manteniendo constante el nivel del agua. En ese caso, decimos que hay un balance dinámico, un equilibrio en movimiento.

Es este tipo de equilibrio el que se produce en reacciones reversibles, es decir, en aquellas reacciones que ocurren en ambas direcciones. Al mismo tiempo que las moléculas de los reactivos se transforman en productos, las moléculas de los productos reaccionan entre sí para formar los reactivos. La reversibilidad de una reacción está representada por flechas en ambas direcciones:
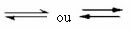
Cuando la tasa de desarrollo de la reacción directa (de formación de los productos) es igual a la tasa de desarrollo del reacción inversa (formación de reactivos), a temperatura constante, significa que la reacción ha alcanzado su equilibrio químico. Y en el caso de reacciones con la presencia solo de moléculas en los reactivos y productos, tenemos un equilibrio molecular.
No pares ahora... Hay más después de la publicidad;)
El siguiente es un ejemplo de la reacción que ocurre entre el gas hidrógeno (H2) y gas de yodo (I2), para la formación de gas yoduro de hidrógeno (HI):
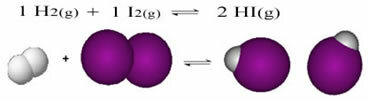
Al comienzo de la reacción, la velocidad de desarrollo de la reacción directa fue mayor, después de todo la concentración de reactivos fue máxima y la de los productos fue cero. Entonces, la tasa de desarrollo de la reacción inversa también fue cero.
Sin embargo, con el tiempo, los gases de hidrógeno y yodo reaccionan y generan el producto. De esta manera, la concentración de reactivos comienza a disminuir y su tasa de desarrollo también disminuye.
A medida que aumenta la concentración de productos y disminuye la concentración de reactivos, la velocidad de desarrollo de la reacción inversa comienza a aumentar. Si la temperatura se mantiene constante, llegará un momento en que las dos velocidades de desarrollo seguirán siendo las mismas, mostrando así que la reacción ha alcanzado el equilibrio químico molecular.
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Equilibrio molecular"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Consultado el 28 de junio de 2021.