El texto "Molécula con carbono asimétrico e isómeros ópticos”Demostró que cuando una molécula tiene un solo carbono asimétrico o quiral (con todos los ligandos diferentes entre sí), tiene dos isómeros ópticamente activos y un isómero ópticamente inactivo (mezcla racémico).
Ahora consideremos el caso de que hay dos o más carbonos asimétricos diferentes, es decir, se consideran diferentes entre sí porque al menos uno de sus ligandos no es el mismo. Por ejemplo, considere la fórmula del aspartamo, que es 180 veces más dulce que la sacarosa (azúcar) y, por lo tanto, se usa en edulcorantes artificiales:
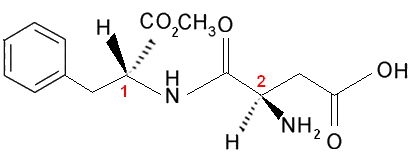
Tenga en cuenta que esta molécula tiene dos carbonos quirales, que se identifican en la imagen por los números 1 y 2. Estos carbonos tienen sus cuatro grupos de enlace diferentes entre sí, por lo que se consideran asimétricos. Al comparar ligandos de carbono 1 con los de carbono 2, vemos que el único ligando que se repite es el H (hidrógeno), siendo, por tanto, distintos carbonos asimétricos.
Esta molécula y todas las que tengan dos carbonos asimétricos siempre tendrán:
4 isómeros ópticamente activos y 2 isómeros ópticamente inactivos (dos mezclas racémicas).Sabemos esto porque las probabilidades posibles son:

Cualquier otro par de isómeros será diastereoisómeros (que no son imágenes especulares entre sí), como una mezcla de carbono-1 diestro y carbono-2 diestro.
Sin embargo, sería muy difícil si tuviéramos que seguir buscando todas las posibilidades para cada molécula, ya que muchas tienen 3, 4, 5 o más carbonos asimétricos.
Por tanto, la forma más sencilla de determinar la cantidad de isómeros ópticamente activos e inactivos de una molécula que tiene varios diferentes carbonos asimétricos es a través de las expresiones matemáticas que se muestran a continuación que fueron propuestas por Van't Hoff y Le Bel:
No pares ahora... Hay más después de la publicidad;)
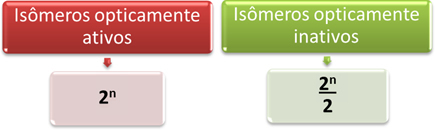
Donde "n" es la cantidad de diferentes carbonos asimétricos en la molécula. Por ejemplo, en el caso del aspartamo, son dos carbonos asimétricos, por lo que tenemos:
- Isómeros ópticamente activos: 2No = 22 = 4;
- Isómeros ópticamente inactivos: 2No = 22 = 2.
2 2
Dio exactamente la cantidad que mencionamos antes.
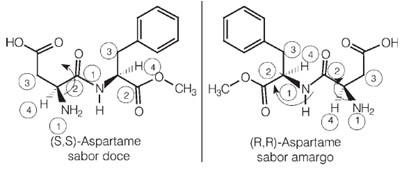
Curiosamente, uno de los enantiómeros del aspartamo tiene este sabor dulce que se usa en los edulcorantes artificiales, pero uno de sus isómeros ópticos tiene un sabor amargo.
Ahora mire otro ejemplo, la molécula de fructosa:
OH OH OH OH OH
│ ║ │ │ │ │
H C ─ C ─ C ─ C ─ C ─ C ─ H
│ │ │ │ │
H OH H H H
La fructosa tiene tres átomos de carbono asimétricos, por lo tanto, tenemos 8 isómeros ópticamente activos y 4 isómeros ópticamente inactivos, que son 4 mezclas racémicas.
- Isómeros ópticamente activos: 2No = 23 = 8;
- Isómeros ópticamente inactivos: 2No = 23 = 4.
2 2
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Isómeros en moléculas con diferentes carbonos asimétricos"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/isomeros-moleculas-com-carbonos-assimetricos-diferentes.htm. Consultado el 28 de junio de 2021.