Antes de introducir el concepto de masa molar y número de moles, veamos algunas definiciones importantes en este contexto:
→ Término molar
Molar viene de la palabra molécula, pero ¿qué es exactamente una molécula? Es el conjunto de átomos que se enlazan mediante enlaces químicos.
→ Masa molecular (MM)
Es posible calcular la masa de una molécula mediante la suma de las masas atómicas de cada átomo que forma la molécula respectiva. El resultado se llama Masa Molecular (MM).
¿Cuál sería la masa molecular del sulfuro de hidrógeno (H2S) por ejemplo?
Primero necesitas saber cuál es el masa atomica de cada átomo, que viene dada por la Tabla Periódica de elementos.
Masa atómica de hidrógeno (H) = 1 a.m.u. (unidad por masa atómica)
Masa atómica de azufre (S) = 32,1 a.u.u.
La masa molecular es la suma de las masas atómicas de los átomos.
Nota: el hidrógeno de la molécula de H2S tiene un coeficiente de 2, por lo que debes multiplicar su masa por 2. Calculador:
Masa molecular de H2S = 1 • 2 + 32,1 = 34,1 u
(H) + (S) = (H)2S)
Masa molar y número de lunares.
No pares ahora... Hay más después de la publicidad;)
La masa molar, así como el número de moles, está relacionada con la Constante de Avogadro (6,02 x 1023) a través del siguiente concepto:
'' El número de entidades elementales contenidas en 1 mol corresponde a la constante de Avogadro, cuyo valor es 6.02 x 1023 mol-1.''
Por lo tanto, la masa molar es la masa de 6.02 x 1023 entidades químicas y se expresa en g / mol.
Mapa mental - Mol
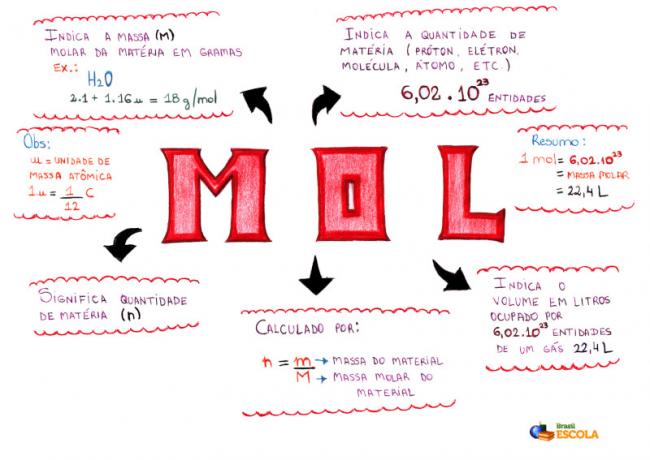
* Para descargar el mapa mental, Haga clic aquí!
Ejemplo: H2s
Masa molecular = 34,1 u
Masa molar (M) = 34,1 g / mol
Esto significa que, a 34,1 g / mol de sulfuro de hidrógeno, tenemos 6,02 x 1023 moléculas o 1 mol de moléculas de sulfuro de hidrógeno.
Conclusión
La masa molecular y la masa molar tienen los mismos valores, lo que difiere es la unidad de medida. La masa molar está relacionada con el número de moles que viene dado por la constante de Avogadro.
* Mapa mental de mí. Diogo Lopes
Por Líria Alves
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
SOUZA, Líria Alves de. "Masa molar y número molar"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/massa-molar-numero-mol.htm. Consultado el 27 de junio de 2021.



