LA Cinética química es un campo que estudia los factores que influyen en la velocidad de desarrollo de las reacciones químicas, es decir, la velocidad a la que tienen lugar. Cada vez hay más investigación en esta área, ya que a menudo queremos acelerar algunas reacciones o ralentizar otras. Esto es especialmente importante para las industrias y esta investigación tiene importantes consecuencias tecnológicas.
Pero dado que la velocidad de una reacción puede variar en cada intervalo de tiempo y de una sustancia a otra, es habitual calcular la velocidad media de reacción.
Considere la siguiente reacción genérica, en la que los coeficientes son las letras minúsculas y los reactivos y productos están representados por las letras mayúsculas:
a A + b B → c C + d D
La velocidad media de esta reacción se dará dividir la velocidad media de reacción de cualquiera de las sustancias que reaccionan o la velocidad media de formación de cualquiera de los productos por su coeficiente respectivo en la ecuación química. Esto viene dado por:
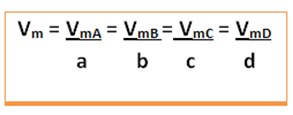
Por ejemplo, considere la reacción de descomposición del peróxido de hidrógeno:
2 horas2O2 (aq) → 2 H2O(1) + 1 O2 (g)
Digamos que en 1 minuto se formaron 0.3 mol / L de H2O y 0,15 mol / L de O2, mientras que 0.3 mol / L de H se descomponen2O2, es decir, las tasas medias de descomposición y formación de estas sustancias en la reacción son:
VmH2O2 = 0,3 mol / L. min
VmH2O = 0,3 mol / L. min
VmO2 = 0,15 mol / L. min
La velocidad promedio de la reacción global se obtendrá tomando uno de estos valores y dividiéndolo por el coeficiente respectivo en la ecuación:
Vmetro = VmH2O2 = 0,3 mol / L. min = 0,15 mol / L. min
2 2
Vmetro = VmH2O = 0,3 mol / L. min = 0,15 mol / L. min
2 2
Vmetro = VmO2 = 0,15 mol / L. min = 0,15 mol / L. min
1 1
Tenga en cuenta que los tres valores son iguales, por lo tanto, la velocidad de reacción es la misma que una función de cualquier reactivo o producto, en el mismo intervalo de tiempo.
Sin embargo, ¿cómo se encontraron los valores de las velocidades promedio de cada una de las sustancias involucradas en estas reacciones?
Se puede calcular dividiendo la variación en la concentración de la sustancia (reactivo o producto) por el intervalo de tiempo. Si vamos a determinar la rapidez promedio de uno de los reactivos de la reacción, tendremos que poner un signo negativo antes, o bien considere el valor de concentración en el módulo ||, ya que, dado que la concentración del reactivo disminuye con el tiempo, el valor de la velocidad sería negativo, pero no hay velocidad negativa.
No pares ahora... Hay más después de la publicidad;)

Por ejemplo, considere la siguiente reacción de descomposición del gas ozono (O3 (g)) en oxígeno gaseoso (O2 (g)):
2 O3 (g) → 3 O2 (g)
Digamos que en un globo había 10 moles de gas ozono, pero después de 1 minuto, solo quedaron 4 moles; esto significa que 6 moles de ozono se convirtieron en gas oxígeno. Entonces tenemos:
2 O3 (g) → 3 O2 (g)
t = 0 min 2 mol / L 0 mol / L
gastos formados
6 mol / L 9 mol / L
t = 1 min 4 mol / L 9 mol / L
Tenga en cuenta que dado que la relación de reacción es 2: 3, entonces si se usaron 6 moles de O3, Se formaron 9 mol de O2. Entonces, después de 1 minuto, tenemos las siguientes velocidades promedio:
Vmetro = - ∆ [El3]
t
Vmetro = - ([O3final - O3inicial])
tFinal - tinicial
Vmetro = - ([4 - 10])
1– 0
Vmetro = 6 mol / L. min→ Durante 1 minuto, 6 mol de ozono reaccionaron en cada litro del sistema.
Vmetro = ∆ [El2]
t
Vmetro = ([O2final - O2inicial])
tFinal - tinicial
Vmetro = ([9 - 0])
1– 0
Vmetro = 9 mol / L. min→ Durante 1 minuto, se formaron 9 moles de oxígeno en cada litro del sistema.
Esto nos muestra que podemos calcular la velocidad promedio en función de los reactivos o en función de los productos.
Ahora, si queremos calcular la velocidad promedio de esta reacción global, simplemente haga lo que mostramos al principio: divida cada una de estas velocidades por sus respectivos coeficientes en la ecuación química:
Vmetro = VmO3 = 6 mol / L. min = 3 mol / L. min
2 21
Vmetro = VmO2 = 9 mol / L. min = 3 mol / L. min
3 3
Vmetro = VmO3 = VmO2
23
Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Velocidad de las reacciones químicas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Consultado el 27 de junio de 2021.



