Para que ocurra una reacción química en una mezcla de soluciones, sus solutos no deben ser los mismos, ya que la reacción ocurre entre ellos.
En los laboratorios y las industrias químicas, la mayoría de las mezclas se producen a partir de la ocurrencia de reacciones y, por tanto, es fundamental conocer la estequiometría de estas reacciones. Esto significa saber cómo equiparar las reacciones y conocer la proporción en número de moles de los reactivos y productos, que viene dada por los coeficientes de la ecuación balanceada.
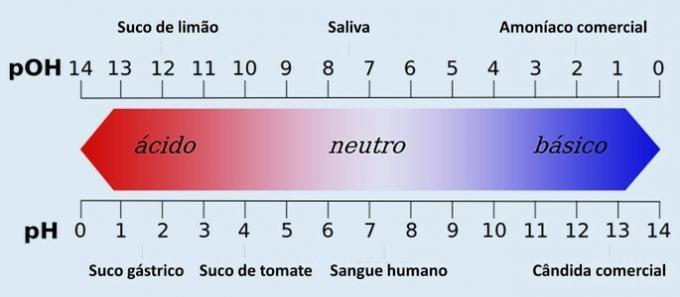
Si conocemos estos detalles, podremos determinar si la solución final es neutra, ácida o básica, además de poder determinar la concentración en mol / L del producto.
Para comprender cómo sucede esto, vea un ejemplo de una reacción entre un ácido y una base:
• Mezclar entre 30 mL de hidróxido de sodio (NaOH) a 0,7 mol / L y 70 mL de ácido clorhídrico (HCl) a 0,3 mol / L.
La reacción que se produce es la siguiente:
1 NaOH + 1 HCl → 1 NaCl +1 H2O
Tenga en cuenta que la relación de reacción es 1: 1. Veamos si la mezcla también está en esta proporción y determinamos si es una mezcla neutra, ácida o básica. Para ello es necesario encontrar los números mol (n) de los reactivos:
NoNo h = MNo h. VNo h
NoNo h = 0,7 mol / L. 0,03 litros
NoNo h = 0,021 mol
NoHCl = MHCl. VHCl
NoHCl = 0,3 mol / L. 0,07 litros
NoHCl = 0,021 mol
No pares ahora... Hay más después de la publicidad;)
Entonces tenemos:
1 NaOH + 1 HCl → 1 NaCl +1 H2O
Proporción: 1 mol 1 mol 1 mol
Número de mol: 0,021 mol 0,021 mol 0,021 mol
Esto significa que la reacción se ajusta a la relación estequiométrica, permaneciendo neutra ya que no hay exceso de ácido o base.
La concentración en mol / L (M) de la sal formada se puede encontrar mediante la fórmula siguiente, recordando que el volumen de la solución es la suma de los volúmenes de ácido y base (30 mL + 70 mL = 100 mL = 0.1L ):
M = No
V
M = 0,021 mol
0,1 L
M = 0,21 mol / L
Sin embargo, si tuviéramos que mezclar una cantidad mayor de NaOH con la misma cantidad de HCl, veríamos que el número de moles de NaOH no obedecería a la relación estequiométrica, quedando en exceso. Así, sabríamos que la solución final presentaría un carácter básico.
Este concepto se usa ampliamente en una técnica llamada valoración, en el que la concentración de una solución desconocida se determina mediante su reacción (con la ayuda de un indicador) con una solución de concentración conocida.

Por Jennifer Fogaça
Licenciada en Química
¿Le gustaría hacer referencia a este texto en una escuela o trabajo académico? Vea:
FOGAÇA, Jennifer Rocha Vargas. "Mezcla de soluciones con aparición de reacciones químicas"; Escuela Brasil. Disponible: https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-ocorrencia-reacoes-quimicas.htm. Consultado el 28 de junio de 2021.