El pH corresponde al potencial hidrógeno de una solución. Está determinada por la concentración de iones de hidrógeno (H+) y sirve para medir el grado de acidez, neutralidad o alcalinidad de una solución determinada.
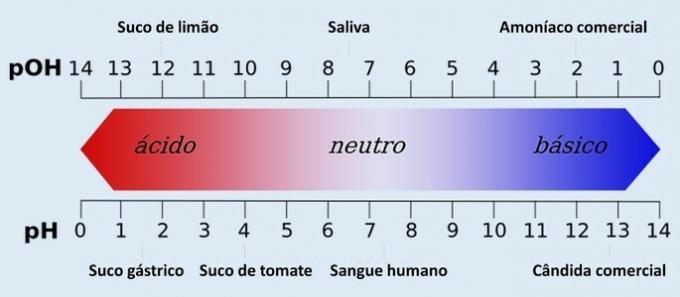
Además del pH, también existe otra cantidad que determina la acidez y basicidad de un sistema acuoso: el pOH (potencial hidroxiliónico). Esta escala tiene la misma función que el pH, aunque se utiliza menos.
escala PH
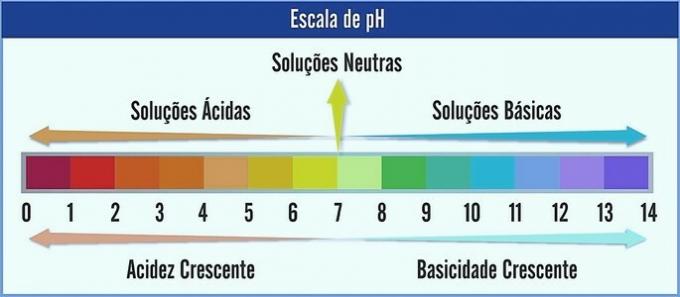
El pH se representa en una escala que va de 0 a 14. Mide la acidez y basicidad de una solución.
Por tanto, el pH 7 representa una solución neutra (por ejemplo, agua pura). Las anteriores se consideran soluciones ácidas (pH ácido) y las posteriores a 7 son las soluciones básicas (pH alcalino).
Con esta observación hecha, el carácter ácido aumenta de derecha a izquierda. El personaje básico, de izquierda a derecha. Tenga en cuenta que cuanto menor sea el valor de pH, más ácida será la solución.
Obtenga más información en:
- Solución tampón
- Valoración
- Reacción de neutralización
Ejemplos de
Soluciones ácidas
| Solución | pH |
|---|---|
| Jugo gastrico | 2,0 |
| Jugo de limon | 2,2 |
| Vinagre | 3,0 |
| Café | 5,0 |
| Leche de vaca | 6,4 |
Soluciones basicas
| Solución | pH |
|---|---|
| sangre humana | 7,35 |
| Agua de mar | 7,4 |
| Bicarbonato de sodio | 8,4 |
| Leche de magnesia | 10,5 |
| Lejía | 12,5 |
¿Cómo calcular el pH?
En 1909, el químico danés Soren Sörensen (1868-1939) propuso que la acidez de las soluciones, medida en términos de concentraciones de iones H+, transformó sus valores usando logaritmos para facilitar la comprensión.
A una temperatura de 25 ° C, el producto iónico del agua es igual a 10–14 mol2/ L2.
Aplicando el cologaritmo en la expresión, tenemos que:
Mediante esta expresión podemos obtener el valor correspondiente de una escala a otra mediante la resta.
¿Cómo medir el pH?
Controlar el pH es importante no solo con fines científicos, sino también en la vida cotidiana.
Es necesario verificar el pH de la piscina, así como el pH del acuario e incluso el pH del suelo para permitir ciertos tipos de cultivos.
A continuación se muestran las principales formas de medir el pH.
indicador ácido-base
Los denominados indicadores ácido-base se utilizan para medir el pH de una solución. Son sustancias que cambian de color indicando el carácter de la solución. Los indicadores más utilizados son: tornasol y fenolftaleína.

Podómetro
Además de los indicadores, el pH de una solución se puede medir utilizando un instrumento llamado peagómetro. Este dispositivo electrónico mide la conductividad eléctrica de la solución y la convierte a la escala de valores de pH.

Ejercicios de examen de ingreso con comentarios
1. (Enem / 2014) Un investigador se da cuenta de que la etiqueta de uno de los vasos en los que guarda un concentrado de enzimas digestivas es ilegible. No sabe qué enzima contiene el vaso, pero sospecha que es una proteasa gástrica, que actúa en el estómago al digerir las proteínas.
Sabiendo que la digestión en el estómago es ácida y el intestino es básico, ensambla cinco tubos de ensayo con comida. diferente, agregue el concentrado de enzima a soluciones con un pH determinado y espere a ver si la enzima actúa en algún su.
El tubo de ensayo en el que debe actuar la enzima para indicar que la hipótesis del investigador es correcta es el que contiene:
a) cubito de papa en solución con pH = 9
b) trozo de carne en solución con pH = 5
c) clara de huevo hervida en solución con pH = 9
d) porción de fideos en solución con pH = 5
e) bola de mantequilla en solución con pH = 9
Alternativa correcta: b) trozo de carne en solución con pH = 5.
La proteasa es una enzima que digiere proteínas y por ser gástrica actúa en el estómago, cuyo pH es ácido.
Analizando las alternativas, tenemos que:
un error. Las papas tienen un alto contenido de carbohidratos y el pH del concentrado es básico.
b) CORRECTO. La carne contiene proteínas y enzimas que pueden actuar sobre ella, y el pH del concentrado es ácido, como el estómago.
c) INCORRECTO. El pH del concentrado es básico.
d) INCORRECTO. La pasta es rica en carbohidratos.
e) INCORRECTO. El pH del concentrado es básico.
2. (Udesc / 2009) "Lluvia ácida" es un término que se refiere a la precipitación de la atmósfera de lluvia con cantidades mayores de lo normal de ácidos nítrico y sulfúrico.
Los precursores de la lluvia ácida provienen tanto de fuentes naturales, como volcanes y vegetación en descomposición, como de procesos emisiones industriales, principalmente dióxido de azufre y óxidos de nitrógeno de la quema de combustibles fósiles
El pH del agua de lluvia considerada normal es de 5,5 (debido a la presencia de ácido carbónico procedente de la solubilización del dióxido de carbono). Un químico que monitoreaba una región altamente industrializada notó que el pH del agua de lluvia era de 4.5.
Considerando que la acidez está relacionada con la concentración de H3O+, es correcto decir que el agua con pH 4.5 fue:
a) el doble de básico de lo normal.
b) dos veces más ácido de lo normal.
c) diez veces más básico de lo normal.
d) diez veces más ácido de lo normal.
e) cien veces más ácido de lo normal.
Alternativa correcta: d) diez veces más ácido de lo normal.
Según las expresiones pH = - log [H+] y [H+] = 10-pH, tenemos que:
pH = 5,5
[H+] = 10-5,5
pH = 4.5
[H+] = 10-4,5
La diferencia entre los valores es: 10- 5,5 - ( - 4,5) = 10 -1
Como la escala de pH es una escala logarítmica, cambiar una unidad equivale a una solución 10 veces más ácida.
3. (UFMG / 2009) Considere una cierta cantidad de agua y jugo de limón, mezclados, contenidos en un vaso. Revise estas tres declaraciones con respecto a este sistema:
I. El sistema es ácido.
II. El pH del sistema es superior a 7.
III. En el sistema, la concentración de iones H+ es más grande que el OH–.
Con base en este análisis, es CORRECTO afirmar que:
a) solo las declaraciones I y II son correctas.
b) solo las declaraciones I y III son correctas.
c) solo las declaraciones II y III son correctas.
d) las tres afirmaciones son correctas.
Alternativa correcta: b) solo las declaraciones I y III son correctas.
I. CORRECTO El limón contiene ácido cítrico, que en solución libera iones H+ y entonces el sistema es ácido.
II. EQUIVOCADO. El pH es inferior a 7, lo que caracteriza un sistema ácido: cuanto más cercano a 0 es el pH de la solución, más ácido es.
III. CORRECTO El pH ácido es el resultado de la alta concentración de iones H+ en solución, ya que pH = - log [H+].
Para más preguntas, con resolución comentada, asegúrese de verificar:Ejercicios sobre pH y pOH.



