Ο pH διαλύματος δείχνει την περιεκτικότητα (μέτρηση) ιόντων υδρονίου (Η3Ο+) παρόν στη μέση. Αυτό το περιεχόμενο καθορίζει εάν το αναλυθέν διάλυμα έχει όξινο, βασικό ή ουδέτερο χαρακτήρα.
Παρατήρηση: Αξίζει να σημειωθεί ότι η περιεκτικότητα σε υδρόνιο (H3Ο+ ή Η+) μπορεί να αποκτηθεί απλά στο εργαστήριο χρησιμοποιώντας ταινίες δείκτη pH - οι οποίες, ωστόσο, δεν έχουν μεγάλη ακρίβεια στο μέτρο - ή μέσω εξοπλισμού που ονομάζεται peagometer, ο οποίος, αντίθετα, έχει μεγάλη ακρίβεια στη μέτρηση του pH ενός λύση.
Βηματόμετρο ή ποτενσιόμετρο για τη μέτρηση του pH ενός διαλύματος
Για την εκτέλεση του υπολογισμοί που περιλαμβάνουν pH μιας λύσης, μπορούμε να χρησιμοποιήσουμε την ακόλουθη λογαριθμική εξίσωση:
pH = - log [Η3Ο+]
ή
pH = - log [Η+]
ΣΠΟΥΔΑΙΟΣ: Σε υπολογισμούς που αφορούν το pH ενός διαλύματος, χρησιμοποιούμε πάντα τον λογάριθμο βάσης 10.
Χάρτης μυαλού: Υπολογισμός PH λύσεων

* Για να κατεβάσετε τον χάρτη μυαλού σε PDF, Κάντε κλικ ΕΔΩ!
Από την παραπάνω λογαριθμική εξίσωση, μπορούμε ακόμα να χρησιμοποιήσουμε την ακόλουθη απλοποίηση (που λαμβάνεται εφαρμόζοντας μια λογαριθμική συνάρτηση) αυτής της εξίσωσης:
[Χ3Ο+] = 10-ΡΗ
Παρατήρηση: Η παραπάνω απλοποιημένη έκφραση μπορεί να χρησιμοποιηθεί μόνο εάν η τιμή του pH είναι ακέραιος. Διαφορετικά, πρέπει να χρησιμοποιηθεί η λογαριθμική συνάρτηση.
Είναι σημαντικό να τονιστεί ότι οι υπολογισμοί που αφορούν το ρΗ ενός διαλύματος σχετίζονται πάντα με το ρΟΗ (υδροξυλονικό δυναμικό / ΟΗ-), καθώς και οι δύο δυνάμεις βασίζονται στον αυτο-ιονισμό του νερού (Κβ = 10-14, ένα φαινόμενο στο οποίο το νερό παράγει τόσο πολύ Η+ πόσο ω-) και ο νόμος της αραίωσης του Ostwald (όσο πιο αραιωμένο είναι ένα διάλυμα, τόσο μεγαλύτερη είναι η ποσότητα των κατιόντων Η+ ). Ετσι:
σχετικά με αυτοματοποίηση νερού:
κβ = [Η+]. [ω-], έτσι pH + pOH = 14
νόμος του Αραίωση Ostwald(Μέσα από αυτό, μπορούμε να γνωρίζουμε πόσο ιονίζεται ή αποσυντίθεται ένα συγκεκριμένο υλικό στο νερό):
κΕγώ = Μα2
Ki = Σταθερή ιονισμού μιας ουσίας σε υδατικό μέσο.
M = μοριακότητα ή γραμμομοριακή συγκέντρωση της ουσίας στο υδατικό μέσο ·
α2 = βαθμός ιονισμού ή αποσύνδεσης του υλικού στο μέσο.
Η ταξινόμηση ενός διαλύματος ως όξινου, βασικού ή ουδέτερου θα έχει τα ακόλουθα κριτήρια (25) ΟΝΤΟ):
-
ένας η λύση θα είναι ουδέτερη όταν η συγκέντρωση του Η+ είναι ίση με τη συγκέντρωση του ΟΗ- ή έχουν pH ίσο με 7.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
[Χ+] = [ΟΗ-]
ένας το διάλυμα θα είναι όξινο όταν η συγκέντρωση του Η+ είναι μεγαλύτερη από τη συγκέντρωση ΟΗ- ή το pH είναι μεταξύ 0 και 7.
[Χ+]> [ΟΗ-]
ένας η λύση θα είναι βασική όταν η συγκέντρωση του Η+ είναι μικρότερη από τη συγκέντρωση ΟΗ- ή το pH είναι μεταξύ 7 και 14.
[Χ+] -]
Δείτε μερικά παραδείγματα υπολογισμών που αφορούν το pH των διαλυμάτων:
1º)Γνωρίζοντας ότι η συγκέντρωση του υδρονίου σε έναν καφέ ισούται με 1,10-5, ποιο θα είναι το pH που υπάρχει σε αυτό το διάλυμα;
πώς να ασκηθείτε παρείχε τη συγκέντρωση υδρονίου για καφέ, μπορούμε χρησιμοποιήστε τον απλοποιημένο τύπο pH:
[Χ3Ο+] = 10-ΡΗ
1.10-5 = 10-ΡΗ
10-5 = 10-ΡΗ
-5 = -pH
pH = 5
Καθώς το ρΗ είναι μικρότερο από 7, το διάλυμα είναι όξινο.
2º) (UFU) Ποιο είναι το pH ενός διαλύματος οξικού οξέος 0,045 mol / L, υποθέτοντας το Κ τουΕγώ = 1,.10-5? Δεδομένα: log 2 = 0.3; log 3 = 0,48.
Δεδομένα άσκησης:
Μ = 0,045 mol / L
κΕγώ = 1,8.10-5
log 2 = 0,3
log 3 = 0,48
Πώς η άσκηση παρείχε το μοριακότητα (Μ) και η σταθερά ιονισμού (ΚΕγώ),αρχικά ας προσδιορίσουμε τον βαθμό ιονισμού του αναφερθέντος οξέος, επειδή η συγκέντρωση του υδρονίου (Η3Ο+ ή Η+) είναι πάντα το αποτέλεσμα του πολλαπλασιασμού μεταξύ της μοριακότητας και του βαθμού ιονισμού. Σύντομα:
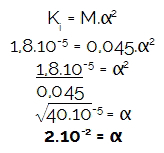
Στη συνέχεια, ας υπολογίσουμε το ποσότητα μοριακής πολλαπλασιασμού υδρονίου του οξέος με τον βαθμό ιονισμού που βρέθηκε:
[Χ3Ο+] = Μα
[Χ3Ο+] = 0,045.2.10-2
[Χ3Ο+] = 0,09.10-4
[Χ3Ο+] = 9.10-4 φίλη αλήτη
Τέλος, βάζουμε το τιμή συγκέντρωσης υδρονίου στη λογαριθμική εξίσωση pH:
pH = - log [Η3Ο+]
pH = - log 9.10-4
pH = 4 - log 9
pH = 4-log 32
pH = 4 - 2. (ημερολόγιο 3)
pH = 4- (2.0.48)
pH = 4-0.96
pH = 3,04
Καθώς το ρΗ είναι μικρότερο από 7, το διάλυμα είναι όξινο.
3º)(Cefet-PR) A 45 ΟC, το Kw ενός ουδέτερου διαλύματος ισούται με 4,10-4. Ποια είναι λοιπόν η τιμή pH αυτής της λύσης σε αυτήν τη θερμοκρασία; Δεδομένα καταγραφής 2 = 0,3.
Πώς σας λέει η άσκηση είναι η λύση ουδέτερος, σύντομα [Χ3Ο+] ισούται με [OH-]:

Τέλος, βάζουμε το τιμή συγκέντρωσης υδρονίου στη λογαριθμική εξίσωση pH:
pH = - log [Η+]
pH = - log 2.10-7
pH = 7 - log 2
pH = 7-0.3
pH = 6,7
Καθώς το pH είναι σχεδόν 7, το διάλυμα είναι ουδέτερο (όπως υποδεικνύεται στη δήλωση άσκησης) επειδή η θερμοκρασία είναι 45 ΟΝΤΟ.
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Υπολογισμοί που περιλαμβάνουν pH διαλυμάτων". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Νόμος του Ostwald, σταθερά ιονισμού, μοριακή συγκέντρωση, βαθμός ιονισμού, ασθενής ηλεκτρολύτης, αριθμός ιονισμένων mol, Friedrich Wilhelm Ostwald, μονοοξέα, μονοβάσεις.


