Αντιδράσεις σουλφονισμού στα αλκάνια αυτοί είναι οργανικές αντιδράσεις υποκατάστασης, πραγματοποιείται με σκοπό την παραγωγή σουλφονικά οξέα (οργανικές ενώσεις που έχουν την ομάδα SO3Η προσκολλημένη σε άτομο άνθρακα ή σε αλυσίδα άνθρακα) και νερό (Η2Ο).
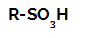
Δομικός τύπος σουλφονικού οξέος
Για τη διεξαγωγή αντίδρασης σουλφονίωσης στις αλκάνια, πρέπει να αναμείξουμε ένα αλκάνιο (ένωση που σχηματίζεται από μια αλυσίδα άνθρακα κορεσμένη με μόνο άτομα άνθρακα και υδρογόνου) και θειικό οξύ (Η2ΜΟΝΟ4) συμπυκνωμένο, υποκείμενο σε θέρμανση (Δ).
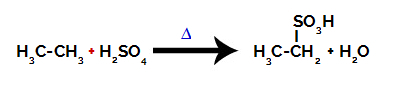
Χημική εξίσωση που αντιπροσωπεύει τη σουλφονίωση ενός αλκανίου δύο άνθρακα
Αρχές της αντίδρασης σουλφονισμού στα αλκάνια
Οπως αντίδραση σουλφονώσεως αλκανίου είναι μια αντίδραση υποκατάστασης, έχουμε μια ανταλλαγή μεταξύ μικρότερων συστατικών ηλεκτροαρνητικότητα των αντιδρώντων, δηλαδή μεταξύ αλκανίου και θειικού οξέος. Το αλκάνιο έχει υδρογόνο και θειικό οξύ, τη σουλφονική ομάδα.
Παρακάτω, έχουμε το βήμα προς βήμα του μηχανισμού του a αντίδραση σουλφονίωσης σε αλκάνια. Για παράδειγμα, θα χρησιμοποιήσουμε το απλούστερο αλκάνιο, το μεθάνιο (CH4):
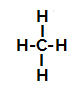
Δομικός τύπος μεθανίου
1ο βήμα: Διακοπή του δεσμού μεταξύ υδροξυλίου (ΟΗ) και θείου (S) σε θειικό οξύ.
Κάθε υδροξυλομάδα που υπάρχει σε θειικό οξύ χαρακτηρίζεται από το ότι είναι περισσότερο ηλεκτροαρνητική. Με θέρμανση κατά τη διάρκεια της αντίδρασης, η τάση είναι ότι ο δεσμός μεταξύ της υδροξυλομάδας και του θείου είναι σπασμένος:
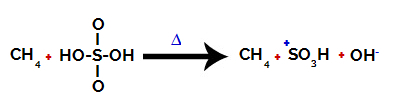
Διακοπή του δεσμού μεταξύ θείου και υδροξυλίου
Ωστόσο, η διακοπή του δεσμού όλων των υδροξυλίων δεν συμβαίνει λόγω της ηλεκτρονικής αναδιάταξης στη δομή. Λαμβάνεται τότε ένα ανιόν υδροξειδίου (ΟΗ).-) και ένα σουλφονικό κατιόν.
2ο βήμα: Η ομάδα υδροξυλίου επιτίθεται στο μόριο αλκανίου.
Στη συνέχεια, η υδροξυ ομάδα (ΟΗ-εκτελεί επίθεση στο αλκάνιο, προκαλώντας τη διάσπαση του δεσμού μεταξύ του άνθρακα και του υδρογόνου (το οποίο είναι πιο εύθραυστο λόγω της διαφοράς στην ηλεκτροπαραγωγικότητα μεταξύ τους).
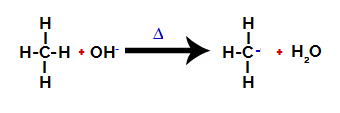
Σπάσιμο του δεσμού μεταξύ του άνθρακα και του υδρογόνου στα αλκάνια
Σημείωση: Η διακοπή του δεσμού μεταξύ άνθρακα και υδρογόνου θα συμβαίνει πάντα συχνότερα σε άνθρακα χαμηλότερης ηλεκτρονικής πυκνότητας ή φορτίου. Όσο λιγότερα άνθρακα υδρογόνου έχει, ή όσο περισσότερες ομάδες συνδέονται με αυτό, τόσο χαμηλότερη είναι η πυκνότητα ηλεκτρονίων. Έτσι έχουμε:
Τριτογενής άνθρακας
Αφού σπάσει ο δεσμός, το αλκάνιο γίνεται άνθρακας με έλλειψη ηλεκτρονίων (carbocation). Η ομάδα υδροξειδίου (OH)-) αλληλεπιδρά με το απελευθερούμενο υδρογόνο και σχηματίζει ένα μόριο νερού.
3ο βήμα: Επίθεση της σχηματισμένης ρίζας στη σουλφονική ομάδα.
Τέλος, η σουλφονική ομάδα δέχεται επίθεση από το υπόλοιπο αλκάνιο, σχηματίζοντας ένα σουλφονικό οξύ.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
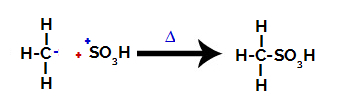
Δομές που αλληλεπιδρούν και σχηματίζουν σουλφονικό οξύ
Παραδείγματα εξισώσεων που αντιπροσωπεύουν αντιδράσεις σουλφονίωσης σε αλκάνια
1ο Παράδειγμα: Σουλφόνωση του προπανίου.
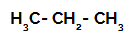
Δομικός τύπος προπανίου
Το προπάνιο έχει δύο πρωτογενείς άνθρακες και έναν δευτερεύοντα άνθρακα, οι οποίοι έχουν διαφορετικά φορτία επειδή συνδέονται με διαφορετικές ποσότητες υδρογόνου. Δεδομένου ότι ο άνθρακας είναι περισσότερο ηλεκτροαρνητικός από το υδρογόνο, αυτοί οι άνθρακες έχουν διαφορετικές πυκνότητες ηλεκτρονίων.
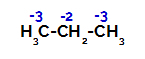
Κατανομή φορτίων σε κάθε άτομο άνθρακα προπανίου
Στους πρωτογενείς άνθρακες, το φορτίο είναι -3 (επειδή συνδέεται με τρία υδρογόνα) και στον δευτερογενή άνθρακα, το φορτίο είναι -2 (επειδή συνδέεται με δύο υδρογόνα). Έτσι, θα υπάρξει μια διακοπή του δεσμού μεταξύ άνθρακα και υδρογόνου, μερικές φορές στον άνθρακα 1 (ενός μορίου), μερικές φορές στον άνθρακα 2 (ενός άλλου μορίου).
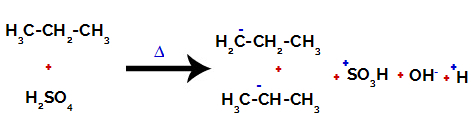
Σπάσιμο του δεσμού μεταξύ άνθρακα και υδρογόνου σε διαφορετικούς άνθρακες
Μετά τα διαλείμματα μεταξύ των δεσμών, τόσο στο θειικό οξύ όσο και στο αλκάνιο, υπάρχει ο σχηματισμός προϊόντα με την αντικατάσταση του υδρογόνου στον άνθρακα 1 από μια σουλφονική ομάδα, και το ίδιο συμβαίνει και στον άνθρακα 2.
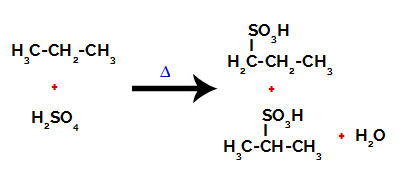
Προϊόντα που σχηματίζονται από τη σουλφονίωση του προπανίου
2ο Παράδειγμα: Σουλφονίωση του 2-μεθυλο-βουτανίου.

Δομικός τύπος 2-μεθυλ-βουτανίου
Το 2-μεθυλ-βουτάνιο έχει τρεις πρωτεύοντες άνθρακες, έναν δευτερεύοντα άνθρακα και έναν τριτοταγή άνθρακα, οι οποίοι έχουν διαφορετικά φορτία και, κατά συνέπεια, διαφορετικές ηλεκτρονικές πυκνότητες, όπως φαίνεται στην ακόλουθη δομή:
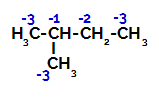
Κατανομή ηλεκτρονικών φορτίων σε 2-μεθυλ-βουτάνιο
Επομένως, υπάρχουν σε 2-μεθυλ-βουτάνιο πολλές δυνατότητες διάσπασης του δεσμού μεταξύ άνθρακα και υδρογόνου, που μπορεί να συμβεί σε άνθρακα 1 (ενός μορίου), άνθρακα 2 (ενός άλλου μορίου), άνθρακα 3 ή άνθρακα 4. Ωστόσο, είναι αξιοσημείωτο ότι η διακοπή στον αριθμό άνθρακα 2 είναι πιο συχνή.
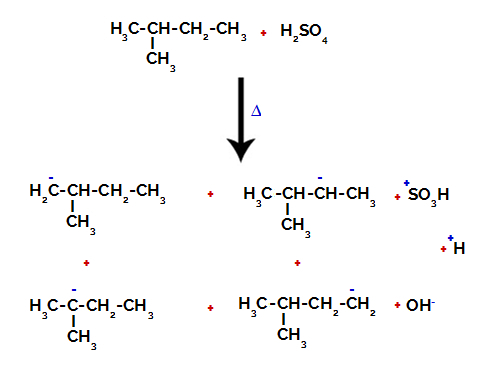
Σπάσιμο του δεσμού μεταξύ άνθρακα και υδρογόνου σε διαφορετικούς άνθρακες
Μετά τη θραύση μεταξύ των δεσμών, τόσο σε θειικό οξύ όσο και σε αλκάνιο, ο σχηματισμός προϊόντα με την αντικατάσταση του υδρογόνου στον άνθρακα 1 από μια σουλφονική ομάδα, και το ίδιο συμβαίνει και στο άνθρακας 2.

Προϊόντα που σχηματίζονται από τη σουλφονίωση του 2-μεθυλο-βουτανίου
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Αντιδράσεις σουλφονισμού στα αλκάνια". Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm. Πρόσβαση στις 28 Ιουνίου 2021.