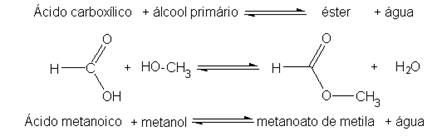
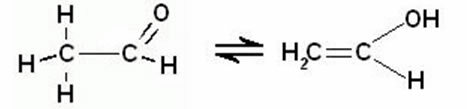Το πολωμένο φως παρατηρήθηκε για πρώτη φορά το 1808 από τους Malus και Huygens, όταν παρατηρούσαν μια δέσμη του φωτός που διέρχεται από την Ισλανδία, ένα διαφανές κρύσταλλο από μια ποικιλία ανθρακικών. ασβέστιο.

Το 1812, ο Jean-Baptiste Biot παρατήρησε ότι η πολωμένη ακτίνα περιστράφηκε, σε μερικούς κρυστάλλους, προς τα δεξιά και, σε άλλους, προς τα αριστερά. Μια σημαντική παρατήρηση που έκανε ήταν ότι δεν ήταν μόνο στερεές ουσίες ή καθαρά υγρά περιστρέφεται η πολωμένη ακτίνα φωτός, αλλά ακόμη και υδατικά διαλύματα ορισμένων οργανικών ουσιών το είχαν αυτό ιδιοκτησία. Αυτό έδειξε ότι Το φαινόμενο που παρατηρήθηκε οφείλεται στη δομή του ίδιου του μορίου.
Ο Biot εφηύρε μια συσκευή για να παρατηρήσει το φαινόμενο της απόκλισης από το επίπεδο του πολωμένου φωτός, το οποίο έγινε γνωστό ως πολωσίμετρο. Το 1842 τελειοποιήθηκε από τον Ventzke, ο οποίος προσάρμοσε ένα πρίσμα Nicol στη συσκευή, και χρόνια αργότερα ο Mitscherlich εισήγαγε τη χρήση μονοχρωματικού φωτός στις παρατηρήσεις.
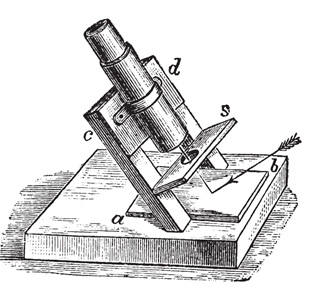
Αλλά μόνο το 1846 εξηγήθηκε αυτό το φαινόμενο, μέσω μελετών του
Λουί Παστέρ, που ήταν μαθητής του Biot. Κατά τη διαδικασία ζύμωσης του χυμού σταφυλιών, για την παραγωγή κρασιού, σχηματίζονται δύο οξέα: τρυγικό οξύ και ρακεμικό οξύ.
Η σφραγίδα που εκτυπώθηκε από την Κεντροαφρικανική Δημοκρατία δείχνει τον Louis Pasteur (1822-1895), Χημικός και Μικροβιολόγος, περίπου το 1985 *
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Αυτά τα δύο οξέα είχαν τον ίδιο μοριακό τύπο και τις ίδιες ιδιότητες, ωστόσο, συμπεριφέρθηκαν διαφορετικά όταν υποβλήθηκαν σε πολωμένη ακτίνα φωτός. Ήταν ήδη γνωστό ότι το το τρυγικό οξύ ήταν οπτικά ενεργό, περιστρέφοντας το πολωμένο επίπεδο φωτός προς τα δεξιά. Ήδη τα άλατα του το ρακεμικό οξύ ήταν ανενεργό υπό πολωμένο φως.
Ο Παστέρ διαπίστωσε ότι ενώ το τρυγικό οξύ αποτελείται από έναν μόνο τύπο μορίου, το ρακεμικό οξύ είχε δύο τύπους. Μελετώντας προσεκτικά τα άλατα που σχημάτισαν και τα δύο οξέα, ο Pasteur διαπίστωσε ότι οι κρύσταλλοι τρυγικού οξέος ήταν ασύμμετροι και οι κρύσταλλοι ρακεμικού οξέος. Ωστόσο, ορισμένοι κρύσταλλοι του τελευταίου είχαν διαφορετικό πρόσωπο προς τα δεξιά και άλλοι προς τα αριστερά.
Χωρίζει προσεκτικά αυτούς τους κρυστάλλους και τους διαλύει ξεχωριστά σε νερό. Αφού εξέτασε αυτές τις λύσεις, το βρήκε και τα δύο ήταν οπτικά ενεργά. Ως εκ τούτου, το ρακεμικό οξύ δεν ήταν καθαρό, στην πραγματικότητα, αποτελούταν από μισό τύπο δεξατρωτικού τρυγικού οξέος (το οποίο αποκλίνει από το σχέδιο σωστής πόλωσης) και το άλλο μισό του τύπου λεβοτοριακού τρυγικού οξέος (το οποίο μετατοπίζει το επίπεδο πόλωσης στο αριστερά).Δεδομένου ότι αυτοί οι δύο τύποι προκάλεσαν απόκλιση της ίδιας τιμής, αλλά με την αντίθετη κατεύθυνση, ο ένας κατέληξε να ακυρώσει τον άλλο και η ουσία έγινε οπτικά ανενεργή.
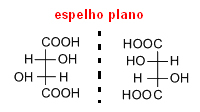
Έτσι, όταν ένα μόριο έχει ασύμμετρους άνθρακες, όπως στην περίπτωση του τρυγικού οξέος, δημιουργεί δύο οπτικά ισομερή, του ίδιου μοριακού τύπου, αλλά με διαφορετικές οπτικές δραστηριότητες.
* Πιστώσεις εικόνας: rook76 και Shutterstock.com
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ιστορία του οπτικού ισομερισμού"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/historia-isomeria-Optica.htm. Πρόσβαση στις 28 Ιουνίου 2021.