Ενας αντίδραση προσθήκης είναι μια χημική διαδικασία στην οποία άτομα μιας ανόργανης ουσίας προστίθενται σε ένα οργανικό μόριο, το οποίο πρέπει να έχει ένα από τα ακόλουθα χαρακτηριστικά:
Ανοικτή δομή που περιέχει δέσιμο ή pi συνδέσεις;
Κορεσμένη κλειστή δομή (μόνο με συνδέσεις σίγμα);
Κλειστή ακόρεστη δομή (με pi ή αρωματικό δεσμό).
Οι οργανικές ενώσεις που έχουν αυτά τα χαρακτηριστικά έχουν ως εξής Υδρογονάνθρακες:
αλκένια;
Αλκίνες;
Αλκαδιένους;
Κυκλάνοι;
Κύκλοι;
Αρωματικά.
Κατά τη διάρκεια ενός αντίδραση προσθήκης, ένας ή περισσότεροι δεσμοί pi ή ένας δεσμός σίγμα (στην αποκλειστική περίπτωση ενός κυκλάν) έχουν σπάσει προκαλώντας δύο ή περισσότερα ελεύθερα σθένη (σημεία σύνδεσης) στους εμπλεκόμενους άνθρακες, όπως στο παράδειγμα βελάζω:
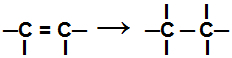
Σπάζοντας τον δεσμό pi σε αλκένιο
Αφού σπάσει αυτός ο δεσμός, η προσθήκη ατόμων πρέπει να πραγματοποιηθεί στις νέες θέσεις σύνδεσης που δημιουργούνται στην οργανική ένωση. Παραθέτουμε παρακάτω τους τύπους αντιδράσεις προσθήκης που μπορεί να πραγματοποιηθεί με οργανικές ενώσεις.
υδρογόνωση
Σε αυτό αντίδραση προσθήκηςΕκτός από την οργανική ένωση, το άλλο αντιδραστήριο είναι αέριο υδρογόνο (Η2). Σε κάθε έναν από τους άνθρακες, όπου συμβαίνει η σχάση (σπάσιμο του δεσμού σίγμα ή π, όπως φαίνεται προηγουμένως), θα υπάρχει ο δεσμός ενός ατόμου υδρογόνου που αναφέρεται στην ποσότητα των σπασμένων δεσμών.
Όταν πραγματοποιούμε την υδρογόνωση του κυκλοβουτανίου, για παράδειγμα, ένας δεσμός σίγμα διακόπτεται μεταξύ των ανθράκων 1 και 2. Στη συνέχεια, ένα άτομο υδρογόνου συνδέεται σε καθέναν από αυτούς τους άνθρακες:
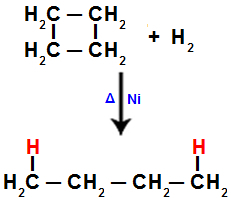
Εξίσωση που αντιπροσωπεύει την υδρογόνωση σε κυκλοβουτάνιο
Αλογόνωση
Εκτός από την οργανική ένωση, το άλλο αντιδραστήριο σε αυτό αντίδραση προσθήκης είναι ένα μοριακό αλογόνο (αέριο χλώριο-Cl)2, αέριο φθόριο-F2, στερεό ιώδιο-Ι2 και υγρό βρώμιο-Br2). Σε κάθε άνθρακα, όπου συμβαίνει η σχάση (σπάσιμο του δεσμού σίγμα ή π, όπως φαίνεται παραπάνω), θα υπάρχει ο δεσμός ενός ατόμου αλαγόνο αναφερόμενος στον αριθμό των σπασμένων συνδέσεων.
Έτσι, όταν πραγματοποιούμε την αλογόνωση (χρησιμοποιώντας αέριο χλώριο) του κυκλοπροπενίου, ο δεσμός pi σπάει μεταξύ των ανθράκων 1 και 2. Στη συνέχεια, ένα άτομο χλωρίου συνδέεται σε καθέναν από αυτούς τους άνθρακες:

Εξίσωση που αντιπροσωπεύει την αλογόνωση στο κυκλοπροπένιο
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Αντίδραση προσθήκης με αλογονίδιο
Ένα αλογονίδιο είναι ένα ανόργανο υδρικό οξύ, που σχηματίζεται από ένα άτομο υδρογόνου και ένα άτομο υδρογόνου. αλογόνο, όπως υδροχλωρικό οξύ (HCl), υδροφθορικό οξύ (HF), υδροβρωμικό οξύ (HBr), οξύ υδροϊωδικό (HI).
Στο αντίδραση προσθήκης με αλογονίδιο, εκτός από την οργανική ένωση, το άλλο αντιδραστήριο είναι ένα αλογονίδιο, εξ ου και ένας από τους άνθρακες, όπου σχίσιμο (σπάσιμο του δεσμού σίγμα ή π, όπως φαίνεται παραπάνω), πρέπει να λαμβάνει το άτομο υδρογόνου και το άλλο λαμβάνει το αλογονίδιο.
Σύμφωνα με την Ο κανόνας του Μάρκοβνικοφ, το πιο υδρογονωμένο άτομο άνθρακα (ή ο άνθρακας που συνδέεται με μια μικρότερη ρίζα) πρέπει να λάβει το το υδρογόνο και ο λιγότερο υδρογονωμένος άνθρακας (ή ο άνθρακας που συνδέεται με μια μεγαλύτερη ρίζα) πρέπει να λαμβάνουν το αλογονίδιο.
Για παράδειγμα, όταν πραγματοποιούμε αυτήν την αντίδραση σε προπένιο με υδροχλωρικό οξύ (HCl), ο δεσμός pi σπάει μεταξύ των ανθράκων 1 και 2. Στη συνέχεια, το υδρογόνο συνδέεται με τον άνθρακα 1 (περισσότερο υδρογονωμένο) και το χλώριο στον άνθρακα 2 (λιγότερο υδρογονωμένο):
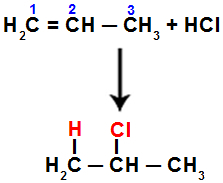
Εξίσωση που αντιπροσωπεύει την προσθήκη με αλογονίδιο σε προπένιο
Αντίδραση ενυδάτωσης
Το μόριο νερού, όταν ιονίζεται, παράγει το κατιόν υδρονίου (Η+) και το ανιόν υδροξειδίου (ΟΗ-). Για το λόγο αυτό, σε αυτό αντίδραση προσθήκηςΕκτός από την οργανική ένωση, το άλλο αντιδραστήριο είναι νερό. Έτσι, ένας από τους άνθρακες, όπου συμβαίνει η σχάση (σπάσιμο του δεσμού σίγμα ή π, όπως φαίνεται παραπάνω), λαμβάνει το κατιόν υδρονίου και ο άλλος δέχεται το ανιόν υδροξειδίου.
Σύμφωνα με τον κανόνα του Markovnikov, το πιο υδρογονωμένο άτομο άνθρακα (ή ο άνθρακας που συνδέεται με μια μικρότερη ρίζα) πρέπει να λαμβάνει το υδρόνιο και ο λιγότερο υδρογονωμένος άνθρακας (ή ο άνθρακας που συνδέεται με μια μεγαλύτερη ρίζα) πρέπει να λαμβάνει το υδροξείδιο.
Όταν ενυδατώνουμε το πεντα-1,4 διένιο, για παράδειγμα, ο δεσμός pi σπάει μεταξύ των ανθράκων 1 και 2 και μεταξύ των ανθράκων 4 και 5. Στη συνέχεια, οι άνθρακες 1 και 5 λαμβάνουν το υδρόνιο και οι άνθρακες 2 και 4 λαμβάνουν το υδροξείδιο:
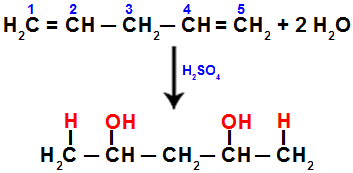
Εξίσωση που αντιπροσωπεύει προσθήκη με ενυδάτωση σε πεντα-1.4 διένιο
Από μένα. Diogo Lopes Dias