Ένας ισοβαρικός μετασχηματισμός συμβαίνει όταν το αέριο βρίσκεται σε σταθερή πίεση. Για παράδειγμα, εάν γίνει σε ανοιχτό περιβάλλον, ο μετασχηματισμός θα είναι ισοβαρικός καθώς η πίεση θα είναι ατμοσφαιρική πίεση που δεν θα αλλάξει.
Σε αυτήν την περίπτωση, η θερμοκρασία και ο όγκος ποικίλλουν. Δύο κορυφαίοι επιστήμονες έχουν μελετήσει πώς συμβαίνει αυτή η διακύμανση των ισοβαρικών μετασχηματισμών. Ο πρώτος που συσχετίζει τον όγκο και τη θερμοκρασία των αερίων ήταν ο Jacques Charles (1746-1823), το 1787, και στη συνέχεια, το έτος 1802, ο Joseph Gay-Lussac (1778-1850) ποσοτικοποίησε αυτήν τη σχέση.
Έτσι, προέκυψε ένας νόμος που εξηγεί τους ισοβαρικούς μετασχηματισμούς των αερίων, οι οποίοι έγιναν γνωστοί ως ο νόμος Charles / Gay-Lussac. Δηλώνεται ως εξής:
"Σε ένα σύστημα σταθερής πίεσης, ο όγκος μιας σταθερής μάζας ενός αερίου είναι άμεσα ανάλογος με τη θερμοκρασία."

Αυτό σημαίνει ότι εάν διπλασιάσουμε τη θερμοκρασία, ο όγκος που καταλαμβάνεται από το αέριο θα διπλασιαστεί επίσης. Από την άλλη πλευρά, εάν μειώσουμε τη θερμοκρασία, ο όγκος του αερίου θα μειωθεί επίσης στην ίδια αναλογία.
Αυτό μπορεί να φανεί σε ένα πολύ απλό πείραμα. Εάν τοποθετήσουμε ένα μπαλόνι στο λαιμό μιας φιάλης, θα παγιδευτεί μια σταθερή μάζα αέρα. Εάν βυθίσουμε αυτό το μπουκάλι σε ένα μπολ με παγωμένο νερό, το μπαλόνι θα ξεφουσκώσει. Τώρα, αν το βάλουμε σε ένα μπολ με ζεστό νερό, το μπαλόνι θα γεμίσει.
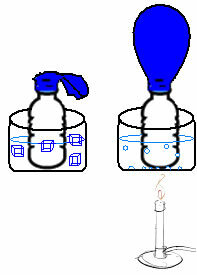
Αυτό συμβαίνει επειδή καθώς αυξάνεται η θερμοκρασία, αυξάνεται η κινητική ενέργεια των μορίων αερίου και αυξάνεται επίσης η ταχύτητα με την οποία κινούνται. Έτσι, το αέριο διογκώνεται, αυξάνοντας τον όγκο που καταλαμβάνει, και το μπαλόνι φουσκώνει. Το αντίθετο συμβαίνει όταν χαμηλώνουμε τη θερμοκρασία, βάζοντάς την σε κρύο νερό.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Αυτή η σχέση μεταξύ θερμοκρασίας και όγκου σε ισοβαρικούς μετασχηματισμούς δίνεται από την ακόλουθη σχέση:
Β = κ
Τ
Το "k" είναι μια σταθερά, όπως φαίνεται στο ακόλουθο γράφημα:
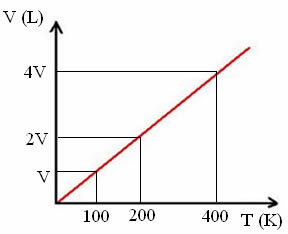
Σημειώστε ότι η αναλογία V / T δίνει πάντα μια σταθερά:
_V_ =_2V_ = _4V_
100 200 400
Έτσι, μπορούμε να δημιουργήσουμε την ακόλουθη σχέση για ισοβαρικούς μετασχηματισμούς:
Βαρχικός = ΒΤελικός
Ταρχικός ΤΤελικός
Αυτό σημαίνει ότι όταν υπάρχει οποιαδήποτε αλλαγή στη θερμοκρασία του αερίου σε σταθερή πίεση, μπορούμε να βρούμε τον όγκο του χρησιμοποιώντας αυτήν τη μαθηματική έκφραση. Το αντίθετο ισχύει επίσης, γνωρίζοντας τον όγκο του αερίου, ανακαλύπτουμε σε ποια θερμοκρασία είναι. Δείτε ένα παράδειγμα:
"Μια αέρια μάζα καταλαμβάνει όγκο 800 cm3 στους -23 ° C, σε μια δεδομένη πίεση. Ποια είναι η θερμοκρασία που καταγράφεται όταν η αέρια μάζα, στην ίδια πίεση, καταλαμβάνει όγκο 1,6 L; "
Ανάλυση:
Δεδομένα:
Βαρχικός = 800 εκ3
Ταρχικός = -23 ºC, προσθέτοντας στους 273 έχουμε 250 K (Kelvin)
ΒΤελικός = 1,6 λίτρα
ΤΤελικός = ?
* Πρώτα πρέπει να αφήσουμε την ένταση στην ίδια μονάδα. Είναι γνωστό ότι 1 dm3 ισούται με 1 λίτρο. σαν 1 dm3 είναι το ίδιο με 1000 cm3, φαίνεται ότι 1 λίτρο = 1 000 cm3:
1 L 1000 cm3
x 800 εκ3
x = 0,8 λίτρα
* Τώρα αντικαθιστούμε τις τιμές του τύπου και βρίσκουμε την τελική τιμή θερμοκρασίας:
Βαρχικός = ΒΤελικός
Ταρχικός ΤΤελικός
0,8_ = 1,6
250 ΤΤελικός
0,8 ΤΤελικός = 250. 1,6
ΤΤελικός = 400
0,8
ΤΤελικός = 500K
* Προχωρώντας στην κλίμακα Κελσίου, έχουμε:
T (K) = T (° C) + 273
500 = Τ (° C) + 273
Τ (° C) = 500 - 273
T (° C) = 227 ° C
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ισοβαρικός Μετασχηματισμός"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Πρόσβαση στις 27 Ιουνίου 2021.
Τι είναι τα αέρια, ποιες είναι οι ιδιότητες των αερίων, μοριακών ενώσεων, συμπιεστότητας, σταθερού όγκου, κινητικής ενέργειας μέση, απόλυτη θερμοκρασία αερίου, ιδανικό αέριο, Πραγματικά αέρια, τέλειο αέριο, μεταβλητές κατάστασης αερίου, όγκος αερίου, εποχές
Χημεία

Οι νόμοι του Gay-Lussac, ο νόμος του Proust, η χημική αντίδραση, η σταθερή αναλογία, οι μάζες των ουσιών, η καθαρή ουσία, η ανάλυση ποιοτικός και ποσοτικός, νόμος τέλειων αερίων, νόμος σταθερών αναλογιών, νόμος ορισμένων αναλογιών, νόμος ογκομετρικοό.