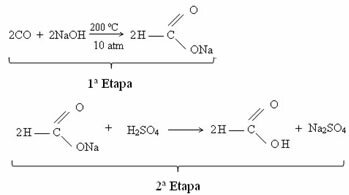
ενεργά ισομερή ή οπτικά ενεργά ισομερή (IOA) είναι μόρια μιας συγκεκριμένης χημικής ουσίας που μπορούν να πραγματοποιήσουν την πόλωση και την απόκλιση του σχέδιο του φως δεξιά ή αριστερά. Για να ελέγξετε εάν μια ουσία έχει ενεργά ισομερή ή όχι, απλώς ελέγξτε αν υπάρχει ασύμμετρος άνθρακας στη δομική του φόρμουλα:

Αναλύοντας την αλυσίδα που απεικονίζεται στην παραπάνω εικόνα, μπορούμε να δούμε ότι το Ο κεντρικός άνθρακας έχει τέσσερα διαφορετικά προσδέματα (ΟΗ, Η, CH3 και Cl), που το καθιστά α άνθρακας ασύμμετρη, που ονομάζεται επίσης άνθρακας χειραλικός. Έτσι, κάθε φορά που μια αλυσίδα έχει έναν ή περισσότερους χειρομορφικούς άνθρακες, θα υπάρχουν ενεργά ισομερή.
Εσείς τύποι ενεργών ισομερών(IOA) αυτοί είναι:
Δεξιόχειρας: Ενεργό οπτικό ισομερές που κάμπτει το πολωμένο φως προς τα δεξιά.
Λεβογίρο: Ενεργό οπτικό ισομερές που κάμπτει πολωμένο φως προς τα αριστερά.
Παρατήρηση: Η παρουσία ασύμμετρου άνθρακα σε δομικό τύπο υποδηλώνει ότι η ουσία πρέπει να έχει το levorotatory ισομερές και το dextrorotatory isomer. Δεν εξαρτάται από εμάς να ξέρουμε με ποιο τρόπο εκτρέπεται το φως, καθώς η παρουσία του χειρομορφικού άνθρακα αποδεικνύει ήδη αυτό το γεγονός. Πάντα τα μισά από τα υπάρχοντα μόρια είναι αριστερόχειρα και τα άλλα μισά είναι δεξιά.
Τα μόρια αριστερού και δεξιού χεριού οποιασδήποτε οργανικής ουσίας έχουν πάντα τις ίδιες φυσικές ιδιότητες (σημείο τήξη, σημείο βρασμού, πυκνότητα, διαλυτότητα κ.λπ.), αλλά παρουσιάζουν χημικές δραστηριότητες (συμπεριφορά στον οργανισμό) πολλά διαφορετικά. Ένα παράδειγμα είναι η αδρεναλίνη. Μόνο το μόριο της αδρεναλίνης λεβογύρας δρα στο σώμα, ενώ η δεξτρόγυρα δεν λειτουργεί.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Δείτε τώρα τη δομική φόρμουλα της ουσίας βουταν-2-όλη για να ελέγξετε αν έχει ενεργά ισομερή ή όχι:
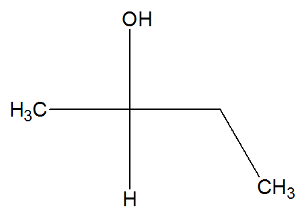
Μπορούμε να παρατηρήσουμε, στη δομή του βουτανίου-2-όλης, που έχει ο άνθρακας 2 τέσσερα διαφορετικά συνδετικά (ΟΗ, Η, CH3, CH2-CH3), οπότε είναι ένας χειρικός άνθρακας και παρουσιάζει ένα δεξιόστροφο ενεργό ισομερές και ένα άλλο ενεργό ισομερές.
Υπολογισμός ενεργών ισομερών (IOA)
Ο Ολλανδός Χημικός Ο Jacobus Henricus van't Hoff ανέπτυξε έναν τύπο που επιτρέπει τον υπολογισμό του αριθμού των ενεργών ισομερών (IOA) που μπορεί να παρουσιάσει μια δεδομένη ουσία. Κοίτα:
IOA: 2όχι
ν: είναι ο αριθμός των χειρόμορφων άνθρακα στον συντακτικό τύπο της ουσίας.
Ακολουθήστε δύο παραδείγματα εφαρμογής του τύπου Vant't Hoff:
5-Διχλωρο-2,3-διυδροξυ-εξανοδιοϊκό οξύ

Στον συντακτικό τύπο της ένωσης, υπάρχουν τρεις χειραλικοί άνθρακες ή ασύμμετρη, ως εκ τούτου:
IOA = 2όχι
IOA = 23
IOA = 8
2,3,4,5-τετραϋδροξυεξάνιο

Στον δομικό τύπο της ένωσης, υπάρχουν τέσσερις χειραλικοί άνθρακες (κόκκινα βέλη) ή ασύμμετρη, ως εκ τούτου:
IOA = 2όχι
IOA = 24
IOA = 16
Παρατήρηση: Υπάρχει πιθανότητα ένας δομικός τύπος να έχει δύο ασύμμετρα άνθρακα που έχουν ακριβώς τους ίδιους προσδέματα. Εάν συμβεί αυτό, θεωρούμε στους υπολογισμούς μόνο 1 για την τιμή του n, όχι 2. Δείτε ένα παράδειγμα:
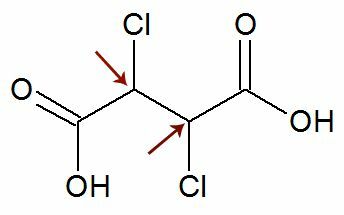
Σαν δύο χειραλικοί άνθρακες αυτοί είναι ισούται, θεωρούμε μόνο ένα άνθρακας στον υπολογισμό:
IOA = 2όχι
IOA = 21
IOA = 2
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Ενεργά ισομερή"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. Πρόσβαση στις 27 Ιουνίου 2021.