Αντιδράσεις μετατόπισης, επίσης λέγεται αντιδράσεις υποκατάστασηςή ακόμα από απλή ανταλλαγή, είναι εκείνα που συμβαίνουν όταν μια απλή ουσία (σχηματίζεται από ένα μόνο στοιχείο) αντιδρά με μια σύνθετη ουσία, «μετατοπίζοντας» την τελευταία σε μια νέα απλή ουσία.
Γενικά, μπορούμε να το ορίσουμε ως εξής:
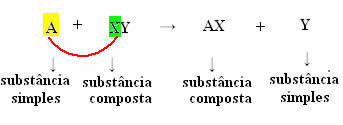
Αλλά για να συμβεί αυτό, η απλή ουσία, στην περίπτωση που συμβολίζεται με το Α, πρέπει να είναι πιο αντιδραστικό από το στοιχείο που θα μετατοπιστεί από την ένωση, μετασχηματίζεται σε μια νέα απλή ουσία (Y).
Ας δούμε ένα παράδειγμα όπου συμβαίνει αυτή η αντίδραση:
Παρατηρήστε το παρακάτω πείραμα στο οποίο ένα φύλλο ψευδαργύρου (Zn) τοποθετείται σε ένα υδατικό διάλυμα θειικού χαλκού (CuSO4). Με την πάροδο του χρόνου, σημειώνεται ότι το διάλυμα θειικού χαλκού αλλάζει από μπλε χρώμα σε λιγότερο έντονο μπλε, καθώς αποχρωματίζεται και υπήρχε εναπόθεση χαλκού στο φύλλο ψευδαργύρου.

Μπορούμε να αναπαραστήσουμε αυτήν την αντίδραση χρησιμοποιώντας την ακόλουθη χημική εξίσωση:

Σημειώστε ότι ο ψευδάργυρος έχει αντικαταστήσει τον χαλκό, πράγμα που σημαίνει ότι ο ψευδάργυρος είναι ο πιο αντιδραστικός.
Δεδομένου ότι και τα δύο είναι μέταλλα, μπορούμε να ελέγξουμε εάν θα συμβεί η απλή ανταλλαγή αντίδρασης, αναλύοντας το ουρά αντιδραστικότητας μετάλλων Φαίνεται παρακάτω:

Σημειώστε ότι ο χαλκός είναι στην πραγματικότητα λιγότερο αντιδραστικός από τον ψευδάργυρο, οπότε αν αποφασίσαμε να κάνουμε το αντίθετο του προηγούμενου πειράματος και βάλτε ένα φύλλο χαλκού σε ένα διάλυμα θειικού ψευδαργύρου, η αντίδραση δεν θα συμβεί, καθώς ο χαλκός δεν θα μπορούσε να αντικαταστήσει το ψευδάργυρος.
Οι αντιδράσεις μετατόπισης είναι ένας τύπος αντίδρασης οξειδοαναγωγής, καθώς υπάρχει μεταφορά ηλεκτρονίων από την απλή ουσία στο σύνθετο. Στη διαδικασία που εξηγήθηκε παραπάνω, ο ψευδάργυρος ήταν αρχικά στην ουδέτερη μορφή του, ο οποίος είναι μεταλλικός και έγινε μέρος μιας ένωσης στην οποία έχει ένα φορτίο 2+, δηλαδή, κάθε άτομο ψευδαργύρου έχει χάσει δύο ηλεκτρόνια. Με το χαλκό, συμβαίνει το αντίθετο, δέχεται δύο ηλεκτρόνια για να περάσει στη μεταλλική, στερεή κατάσταση.
Στην περίπτωση μιας απλής ανταλλαγής αντίδρασης με μη μέταλλα, θεωρείται: η αντίδραση θα συμβεί μόνο εάν το πιο αντιδραστικό μη μέταλλο είναι η απλή ουσία που μπορεί να αντικαταστήσει ένα άλλο λιγότερο αντιδραστικό μη μέταλλο. Η αντιδραστικότητα των αμετάλλων φαίνεται παρακάτω:

Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm



