- Ουδέτερο μέσο:
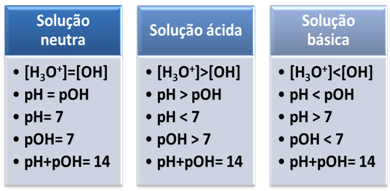
Ένα μέσο θεωρείται ουδέτερο εάν έχει την ίδια συγκέντρωση, σε mol/L, των ιόντων υδρονίου (Η3Ο+) και υδροξείδιο (ΟΗ-).
Ένα παράδειγμα ουδέτερου μέσου που χρησιμεύει ακόμη και ως πρότυπο για άλλα διαλύματα είναι το καθαρό, απεσταγμένο νερό σε θερμοκρασία 25ºC. Σε αυτή τη θερμοκρασία, έχει ακριβώς 1. 10-7 mol/L και των δύο ιόντων. Ως εκ τούτου, το ιονικό προϊόν σας (Κw) ισούται με 10-14 (φίλη αλήτη)2:
κw = [Η3Ο+]. [ω-]
κw = (1. 10-7 φίλη αλήτη). (1. 10-7 mol/L) = 10-14 (φίλη αλήτη)2
Το pH και το pOH δίνονται παρακάτω:
pH= - log [Η3Ο+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
pH = 7pOH = 7
Αυτό μας δείχνει ότι, σε μια ουδέτερη λύση, το Το pH είναι ίσο με pOH.
- Όξινο μέσο:
Σε ένα όξινο μέσο, η συγκέντρωση των ιόντων Η3Ο+ είναι μεγαλύτερο από αυτό των ιόντων ΟΗ-.
Μια τέτοια λύση μπορεί να επιτευχθεί με την προσθήκη ενός μικρού μέρους των ιόντων Η3Ο+, για παράδειγμα, μέσω ενός οξέος.
Σύμφωνα με την αρχή του Le Chatelier, όταν προκαλείται μια διαταραχή σε ένα σύστημα σε ισορροπία, αυτό τείνει να αναπροσαρμόζεται για να μειώσει τις επιπτώσεις αυτής της δύναμης. Αυτό σημαίνει ότι εάν ένα οξύ προστεθεί στο νερό, τα ιόντα Η
3Ο+ θα είναι σε περίσσεια και η ισορροπία θα μετατοπιστεί προς την αντίστροφη κατεύθυνση αντίδρασης, προς τα αριστερά. Έτσι, αυτά τα πλεονάζοντα ιόντα θα αντιδράσουν με τα ιόντα ΟΗ-. Έτσι, η συγκέντρωση των ιόντων ΟΗ- θα μειωθεί και το διάλυμα θα γίνει όξινο.Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)

Το ιοντικό γινόμενο (Kw) είναι πάντα ίσο με 10-14, αλλά η συγκέντρωση των ιόντων Η3Ο+ είναι μεγαλύτερη από τη συγκέντρωση των ιόντων ΟΗ-1. Επομένως, το pH είναι μεγαλύτερο από το pOH σε ένα όξινο μέσο, αλλά το άθροισμά του είναι πάντα ίσο με 14.
Επίσης, όσο μεγαλύτερη είναι η συγκέντρωση των ιόντων Η3Ο+, τόσο μεγαλύτερη είναι η τιμή του pH. Σε θερμοκρασία δωματίου (25°C), pH < 7 και pOH > 7.

- Βασικά μέσα:
Στο βασικό μέσο, η συγκέντρωση των ιόντων ΟΗ- είναι μεγαλύτερο από αυτό των ιόντων Η3Ο+.
Αν προσθέσουμε μια βάση στο νερό, σημαίνει ότι προσθέτουμε ιόντα ΟΗ.- και, όπως εξηγήθηκε στο προηγούμενο σημείο, από την αρχή του Le Chatelier, η ισορροπία της αντίδρασης του Ο αυτοϊοντισμός του νερού θα κινηθεί προς την αντίθετη κατεύθυνση, με την περίσσεια ιόντων να αντιδρά ιόντα Η3Ο+, μειώνοντας τη συγκέντρωσή σας και κάνοντας το διάλυμα βασικό.
Σε αυτή την περίπτωση, το pOH θα είναι μεγαλύτερο από το pH. Σε θερμοκρασία δωματίου (25°C), pH > 7 και pOH < 7.

Εν ολίγοις:
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε ένα σχολικό ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ουδέτερα, όξινα και βασικά μέσα" Σχολή Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Πρόσβαση στις 27 Ιουλίου 2021.


