Ο διαλυτότηταμπορεί να οριστεί ως η μέγιστη δυνατή ποσότητα μιας διαλυμένης ουσίας που μπορεί να διαλυθεί σε μια ορισμένη ποσότητα διαλύτη σε μια δεδομένη θερμοκρασία.
Αυτή η μέγιστη ποσότητα που μπορεί να διαλυθεί είναι επίσης γνωστή ως συντελεστής διαλυτότητας ή βαθμό διαλυτότητας. Αλλά η διαλυτότητα οποιασδήποτε ουσίας εξαρτάται, μεταξύ άλλων, από τον τύπο του διαλύτη στον οποίο διασπείρεται η διαλυμένη ουσία.
Για παράδειγμα, το NaCl (χλωριούχο νάτριο - επιτραπέζιο αλάτι) είναι πολύ διαλυτό στο νερό και σε 1 λίτρο νερού στους 20ºC, μπορούμε να διαλυτοποιήσουμε έως και 360 γραμμάρια από αυτό το αλάτι. Όταν όμως ο διαλύτης μετατρέπεται σε βενζίνη, υπό τις ίδιες συνθήκες όγκου, θερμοκρασίας και πίεσης, το αλάτι δεν διαλύεται.
Γιατί η διαλυτότητα μιας ουσίας ποικίλλει τόσο πολύ από τον ένα διαλύτη στον άλλο;
Ένας από τους παράγοντες είναι ο πόλωση των ενώσεων που εμπλέκονται. Στο παράδειγμα που αναφέρθηκε, έχουμε ότι το το αλάτι είναι πολικό, το νερό είναι πολικό και η βενζίνη είναι μη πολική.
Το άλας σχηματίζεται από άτομα νατρίου (Na) και χλωρίου (Cl) που συνδέονται μέσω ιοντικών δεσμών, στους οποίους το νάτριο σίγουρα δίνει ένα ηλεκτρόνιο στο χλώριο, σχηματίζοντας ιόντα Na+ και Cl-. Καθώς αυτά τα ιόντα έχουν αντίθετα φορτία, έλκονται και συγκρατούνται (Na+Cl-).
Αυτό μας δείχνει ότι το αλάτι είναι πραγματικά πολικό, κάθε ιοντικός δεσμός είναι πολικός, καθώς υπάρχει διαφορά στο ηλεκτρικό φορτίο στην ένωση.
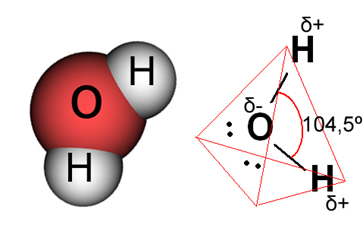
Στην περίπτωση του νερού, ο υπάρχων δεσμός είναι ομοιοπολικός, στον οποίο δύο άτομα υδρογόνου μοιράζονται ηλεκτρόνια με ένα άτομο οξυγόνου. Το μόριο του νερού έχει δύο δίπολα, με το οξυγόνο να έχει μερικώς αρνητικό φορτίο και το υδρογόνο να έχει μερικώς θετικό φορτίο (δ- O ─ H δ+). Όμως, αυτά τα δίπολα δεν αλληλοεξουδετερώνονται, επειδή το μόριο του νερού συναντάται σε γωνία 104,5º, δείχνοντας ότι η κατανομή και το φορτίο κατά μήκος του μορίου δεν είναι ομοιόμορφα. Υπάρχει μεγαλύτερη πυκνότητα αρνητικού φορτίου στο άτομο οξυγόνου του μορίου. Αυτό μας δείχνει ότι το μόριο του νερού είναι πραγματικά πολικό.
Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)
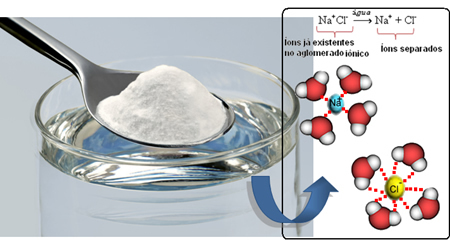
Όταν λοιπόν ανακατεύουμε το αλάτι στο νερό, το θετικό μέρος του άλατος, που είναι τα κατιόντα Na.+, έλκεται από το αρνητικό μέρος του νερού, που είναι το οξυγόνο, και το αρνητικό μέρος του αλατιού (ανιόντα Cl-) έλκεται από το θετικό μέρος του νερού (H+). Κατά συνέπεια, το σωματείο Να+Cl- διασπάται, διαλυτοποιώντας το αλάτι στο νερό.
Η βενζίνη, από την άλλη, σχηματίζεται από ένα μείγμα διαφορετικών υδρογονανθράκων, οι οποίοι είναι μη πολικοί, δηλαδή η κατανομή του ηλεκτρικού φορτίου της βενζίνης είναι ομοιόμορφη. Έτσι, δεν υπάρχει αλληλεπίδραση των ιόντων άλατος με τη βενζίνη και δεν διαλύεται.
Αυτές και άλλες παρόμοιες περιπτώσεις μας οδηγούν στο εξής συμπέρασμα:

Ωστόσο, αυτό δεν μπορεί να θεωρηθεί γενικός κανόνας, καθώς υπάρχουν πολλές περιπτώσεις μη πολικών διαλυμένων ουσιών που διαλύονται καλά σε πολικούς διαλύτες και το αντίστροφο. Έτσι, για να καταλάβουμε γιατί συμβαίνει αυτό, πρέπει να εξετάσουμε έναν ακόμη παράγοντα: τον τύπο του διαμοριακή δύναμη του διαλύτη και της διαλυμένης ουσίας.
Νόμος σχετικά με αυτό στο κείμενο: "Σχέση Διαμοριακής Ισχύος και Διαλυτότητας Ουσιών”.
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε ένα σχολικό ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Σχέση μεταξύ πολικότητας και διαλυτότητας ουσιών"; Σχολή Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/relacao-entre-polaridade-solubilidade-das-substancias.htm. Πρόσβαση στις 27 Ιουλίου 2021.