Όπως αναφέρεται στο κείμενο "Χημική Εξίσωση», για την αναπαράσταση των χημικών αντιδράσεων και την κατανόηση του τρόπου επεξεργασίας τους, τις ποσοτικές και ποιοτικές πτυχές τους, συμφωνήθηκε να χρησιμοποιηθούν χημικές εξισώσεις. Οι χημικές εξισώσεις περιέχουν σύμβολα και αριθμούς που δείχνουν ποιες ουσίες υπάρχουν και τις κατάλληλες αναλογίες με τις οποίες αντιδρούν.
Μέσα από την ερμηνεία αυτών των εξισώσεων, είναι δυνατό να βρούμε σημαντικά δεδομένα που μας βοηθούν να κάνουμε στοιχειομετρικούς υπολογισμούς. Ωστόσο, το πρώτο βήμα λέει ότι η εξίσωση πρέπει να είναι ισορροπημένη, δηλαδή να έχει τον συνολικό αριθμό των ατόμων των αντιδρώντων ίσο με αυτόν των προϊόντων. Μπορείτε να καταλάβετε πώς να κάνετε αυτή την εξισορρόπηση μέσω του κειμένου "Εξισορρόπηση εξισώσεων”.
Πριν, ωστόσο, κατανοήσετε ορισμένες σημαντικές έννοιες σε αυτήν την περίπτωση, όπως η έννοια των όρων: δείκτης, στοιχειομετρικός συντελεστής και μορ. Αυτοί οι όροι θα εξηγηθούν παρακάτω και θα μας δώσουν μια καλύτερη ματιά στο ποσοτικό μέρος της αντίδρασης:
- Δείκτης: είναι ο αριθμός που υποδεικνύει τον αριθμό των ατόμων κάθε στοιχείου που υπάρχουν σε χημικούς τύπους. Αυτός ο αριθμός εμφανίζεται στα δεξιά του εν λόγω στοιχείου και εμφανίζεται ως δείκτης, δηλαδή σε μικρότερο μέγεθος γραμματοσειράς.
Παράδειγμα:
H2Ο (χημικός τύπος ουσίας νερού)
Τι σημαίνει:
- Τα στοιχεία που συνθέτουν αυτήν την ουσία είναι το Η (υδρογόνο) και το Ο (οξυγόνο).
- Ο δείκτης κάθε στοιχείου υποδεικνύει πόσα άτομα από το καθένα υπάρχουν στον τύπο του μορίου του νερού:
H2O→ Ο δείκτης: υπάρχει μόνο 1 άτομο οξυγόνου.
↓
Δείκτης H: δείχνει ότι υπάρχουν 2 άτομα υδρογόνου.
Σημειώστε ότι στην περίπτωση του οξυγόνου δεν υπάρχει γραπτός αριθμός, πράγμα που σημαίνει ότι υπάρχει μόνο 1 άτομο αυτού του στοιχείου, όπως εξηγήθηκε παραπάνω.
Τώρα, υπάρχουν ορισμένες περιπτώσεις όπου οι παρενθέσεις εμφανίζονται σε τύπους. Πώς πρέπει να το ερμηνεύσουμε αυτό; Δείτε το παρακάτω παράδειγμα:
Εδώ3(ΣΚΟΝΗ4)2(χημικός τύπος ουσίας φωσφορικού ασβεστίου)
- Η περιεκτικότητα σε Ca υποδεικνύει ότι υπάρχουν 3 άτομα του στοιχείου ασβεστίου στον χημικό τύπο.
- Το P (φώσφορος) και το Ο (οξυγόνο) βρίσκονται σε παρένθεση, άρα ο δείκτης που βρίσκεται έξω, που σε αυτή την περίπτωση είναι 2, ανήκει και στα δύο. Έτσι, για να μάθετε πόσα άτομα από το καθένα υπάρχουν στον τύπο, πρέπει να πολλαπλασιάσετε τους δείκτες τους ξεχωριστά με τον εξωτερικό δείκτη. Σημειώστε πώς γίνεται αυτό:

Μη σταματάς τώρα… Υπάρχουν και άλλα μετά τη διαφήμιση ;)
P → ευρετήριο 1 O → ευρετήριο 4
P = 1. 2 O = 4. 2
P = 2 O = 8
Άρα υπάρχουν 2 άτομα φωσφόρου και 8 άτομα οξυγόνου.
- Στοιχειομετρικός συντελεστής: είναι ο αριθμός που βρίσκεται πριν από τον τύπο για να υποδείξει την ποσότητα κάθε ουσίας και την αναλογία των μορίων που συμμετέχουν στην αντίδραση. Έτσι, όπως και στην περίπτωση του δείκτη, όταν ο συντελεστής είναι ίσος με 1, δεν είναι απαραίτητο να καταγραφεί, όπως υπονοείται.
Παράδειγμα:
2H2 + 1Ο2 → 2 H2O (αυτή η αντίδραση σχηματισμού νερού φαίνεται στο εισαγωγικό σχήμα)
↓ ↓ ↓
Συντελεστές αντίδρασης
Στην εξίσωση αυτή, μέσω των συντελεστών, φαίνεται ότι δύο μόρια αερίου υδρογόνου αντιδρούν με ένα αέριο οξυγόνο, σχηματίζοντας δύο μόρια νερού ως προϊόν. Έτσι, η στοιχειομετρική αναλογία αυτής της αντίδρασης είναι 2:1:2.
Για να μάθετε τον συνολικό αριθμό των ατόμων κάθε στοιχείου που υπάρχουν στην αντίδραση, είναι απαραίτητο να πολλαπλασιάσετε τους συντελεστές με τους δείκτες κάθε στοιχείου:
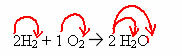
Αντιδραστήρια:
H = 2. 2 = 4 άτομα υδρογόνου
Ο = 1. 2 = 2 άτομα οξυγόνου
Προϊόν:
H = 2. 2 = 4 άτομα υδρογόνου
Ο = 1. 2 = 2 άτομα οξυγόνου
Σημειώστε ότι δώσατε την ίδια ποσότητα στα αντιδρώντα και στα προϊόντα, πράγμα που σημαίνει ότι η αντίδραση ισορροπεί σωστά.
- Mol (ποσότητα ύλης):σε μια χημική εξίσωση, οι συντελεστές θεωρείται ότι δείχνουν την ποσότητα του mol ή την ποσότητα της ύλης. Άρα, στην προηγούμενη περίπτωση έχουμε 2 mol H2 αντιδρώντας με 1 mol O2, δημιουργώντας ως προϊόντα 2 mol H2Ο.
Της Jennifer Fogaça
Πτυχιούχος Χημείας
Θα θέλατε να αναφέρετε αυτό το κείμενο σε ένα σχολικό ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Ποσοτικοί όροι σε μια χημική εξίσωση" Σχολή Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/termos-quantitativos-uma-equacao-quimica.htm. Πρόσβαση στις 27 Ιουλίου 2021.