Μια αντίδραση μείωσης οξείδωσης χαρακτηρίζεται ως ταυτόχρονη διαδικασία απώλειας και κέρδους ηλεκτρονίων, καθώς τα ηλεκτρόνια που χάνονται από άτομο, ιόν ή μόριο λαμβάνονται αμέσως από άλλα.
Για να καταλάβετε, δείτε ένα παράδειγμα:
Ένα διάλυμα θειικού χαλκού (CuSO4 (υδ)) είναι μπλε λόγω της παρουσίας ιόντων Cu2+ διαλύθηκε σε αυτό. Αν βάλουμε μια μεταλλική πλάκα ψευδαργύρου (Zn(μικρό)) σε αυτή τη λύση, με την πάροδο του χρόνου ενδέχεται να παρατηρήσουμε δύο αλλαγές: το χρώμα του διαλύματος θα γίνει άχρωμο και θα εμφανιστεί μια μεταλλική εναπόθεση χαλκού στην πλάκα ψευδαργύρου.
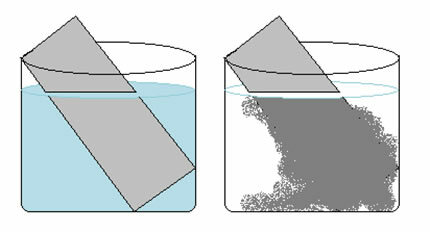
Επομένως, η αντίδραση που εμφανίζεται σε αυτήν την περίπτωση είναι η εξής:
Ζν(μικρό) + CuSO4 (υδ) → Cu(μικρό) + ZnSO4 (υδ)
ή
Ζν(μικρό) + Κου2+(εδώ) + Λειτουργικό σύστημα42-(εδώ) → Cu(μικρό) + Ζν2+(εδώ) + Λειτουργικό σύστημα42-(εδώ)
ή ακόμα
Ζν(μικρό) + Κου2+(εδώ) → Cu(μικρό) + Ζν2+(εδώ)
Σημειώστε ότι πραγματοποιήθηκε μεταφορά ηλεκτρονίων από ψευδάργυρο σε χαλκό. Αναλύοντας μεμονωμένα τον μετασχηματισμό που πραγματοποιήθηκε σε καθένα από αυτά τα στοιχεία, έχουμε:
- Ζν(μικρό) → Zn2+(εδώ)
Ο ψευδάργυρος έχασε 2 ηλεκτρόνια από το μεταλλικό ψευδάργυρο στο κατιόν. Σε αυτή την περίπτωση, ο ψευδάργυρος έχει υποστεί οξείδωση.
- Γάιδαρος2+(εδώ) → Cu(μικρό)
Με το χαλκό, το αντίθετο συνέβη, κέρδισε 2 ηλεκτρόνια, περνώντας από κατιόν χαλκού II σε μεταλλικό χαλκό. Ο χαλκός έχει μειωθεί.
Αυτό εξηγεί τις δύο αλλαγές που παρατηρήθηκαν, καθώς το διάλυμα έγινε άχρωμο επειδή τα ιόντα χαλκού μετατράπηκαν σε μεταλλικό χαλκό, ο οποίος εναποτέθηκε στην πλάκα ψευδαργύρου.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Δεδομένου ότι υπήρχε ταυτόχρονη απώλεια και κέρδος ηλεκτρονίων, αυτή η αντίδραση είναι ένα παράδειγμα αντίδρασης οξειδοαναγωγής, και μέσω αυτού μπορούμε να δημιουργήσουμε τις ακόλουθες έννοιες που επαναλαμβάνονται για όλες τις άλλες αντιδράσεις αυτού τύπος:

Το πιο αντιδραστικό μέταλλο υφίσταται οξείδωσηΈτσι, στο προτεινόμενο παράδειγμα, ο ψευδάργυρος είναι πιο αντιδραστικός από τον χαλκό.
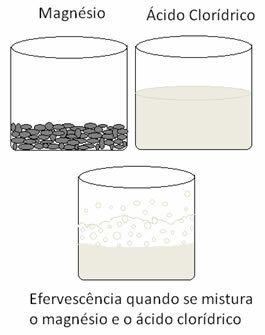
Μια άλλη αντίδραση οξειδοαναγωγής που μπορεί να αναφερθεί συμβαίνει όταν βάζουμε μαγνήσιο ή αλουμίνιο σε διάλυμα υδροχλωρικού οξέος. Σε αυτές τις αντιδράσεις, υδρογόνο από υδροχλωρικό οξύ δέχεται 3 ηλεκτρόνια από αλουμίνιο (ή 2 ηλεκτρόνια από μαγνήσιο), περνώντας το από κατιόν Η+ για αέριο υδρογόνο (Η2), ενώ το μέταλλο γίνεται το κατιόν:
2 Αλ(μικρό) + 6 Ω+(εδώ) → 2 Al3+(εδώ) + 3Η2 (ζ)
mg(μικρό) + 2 Ω+(εδώ) → Mg2+(εδώ) + Χ2 (ζ)
Τα μέταλλα υφίστανται οξείδωση και το υδρογόνο υφίσταται μείωση. Παρακάτω είναι μια εικόνα που δείχνει ότι η προσθήκη μαγνησίου στο υδροχλωρικό οξύ προκαλεί α αναβρασμός, που οφείλεται στην απελευθέρωση αερίου υδρογόνου και το μαγνήσιο εξαφανίζεται, όπως είναι καταναλώθηκε.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Αντιδράσεις οξείδωσης"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/reacoes-oxirreducao.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Χημεία
Λειτουργία αερόσακου, συσκευή σχεδιασμένη για την προστασία των οδηγών, ηλεκτρική ώθηση, αντίδραση χημικής αποσύνθεσης, σύγκρουση, χημικό μείγμα αζιδίου νατρίου, αισθητήρες που βρίσκονται στον προφυλακτήρα αυτοκινήτου, πυριτικό αλκαλικό, αέριο άζωτο.
Χημεία

Φωτοευαίσθητοι φακοί, αντιδράσεις μείωσης οξείδωσης, απώλεια ή αύξηση ηλεκτρονίων, φωτοσυνθετικοί φακοί σε γυαλιά ηλίου, σύνθεση φωτοχρωμικού γυαλιού, τετραεδρικών ατόμων οξυγόνου, κρυσταλλική δομή χλωριούχου αργύρου, υπεριώδες φως, ασημένιο μέταλλο



