Οι αντιδράσεις των πρόσθεση είναι σημαντικές δράσεις όσον αφορά τις οργανικές συνθέσεις, γιατί μέσω αυτών μπορεί να αναπτυχθεί ένας ενδιαφέροντος αριθμός οργανικών ουσιών.
Για να συμβεί η αντίδραση προσθήκης, είναι απαραίτητο να δημιουργηθούν δύο θέσεις δέσμευσης στην ανθρακική αλυσίδα, κάτι που συμβαίνει απλά όταν η αλυσίδα είναι ακόρεστη (παρουσία σύνδεσμος pi). Έτσι, όταν σπάσει ο σύνδεσμος pi, οι τοποθεσίες εμφανίζονται στην αλυσίδα.
Μια ομάδα ουσιών που μπορούν να χρησιμοποιηθούν σε συνθέσεις προσθήκης είναι κυκλοαλκάνια ή κυκλάνων, ομάδα υδρογονανθράκων με κυκλικές και κορεσμένες αλυσίδες. Ξεφεύγουν από τον γενικό κανόνα της πρόσθεσης καθώς δεν έχουν σύνδεσμο pi, αλλά ανάλογα με κάποιες συνθήκες (θερμότητα, μέταλλο καταλύτη, όξινο μέσο) μπορούν να υποστούν ένα σπάσιμο της αλυσίδας μεταξύ δύο ατόμων άνθρακα, προκαλώντας την εμφάνιση δύο θέσεων δέσμευσης για να λάβει χώρα η προσθήκη. Ωστόσο, υπάρχει ένα γεγονός που περιορίζει τη χρήση αυτών των ενώσεων. Το γεγονός είναι η κλήση Η θεωρία του στρες του δακτυλίου, που προτάθηκε από τον Adolf V. Bayer το 1885.
Για να σπάσει ο δεσμός σίγμα μεταξύ των ανθράκων, πρέπει να υπάρχει κάποια αστάθεια μεταξύ των ανθράκων. Αυτή η αστάθεια σχετίζεται με τη γωνία των δεσμών μεταξύ των ανθράκων. Σύμφωνα με την Bayer, η γωνία που παρέχει α μεγάλη σταθερότητα για τον σύνδεσμο sigma είναι 109,47Ο. Έτσι, αλυσίδες που έχουν γωνία μεταξύ ανθράκων μικρότερη από 109,47Ο τείνουν να έχουν αστάθεια στους δεσμούς σίγμα μεταξύ των ανθράκων που σχηματίζουν τις αλυσίδες, γεγονός που ευνοεί τη θραύση τους σε συνδυασμό με μια ιδανική εξωτερική κατάσταση.
Τα μόνα κυκλοαλκάνια που έχουν γωνία μικρότερη από 109,47Ο μεταξύ των ανθράκων του είναι κυκλοπροπάνιο (60Ο), κυκλοβουτάνιο (90Ο) και κυκλοπεντάνιο (108Ο). Το κυκλοπεντάνιο έχει γωνία πολύ κοντά στο 109,47Ο έχει πολύ σταθερούς δεσμούς σίγμα, επομένως δεν μπορεί να υποστεί καμία αντίδραση προσθήκης. Παρακάτω έχουμε τις δομές αυτών των τριών κυκλοαλκανίων:

Δομικός τύπος κυκλοπροπανίου, κυκλοβουτανίου και κυκλοπεντανίου, αντίστοιχα
Παρατήρηση: Οποιοδήποτε κυκλοαλκάνιο έχει περισσότερους από 5 άνθρακες στην αλυσίδα θα πραγματοποιήσει μια αντίδραση υποκατάστασης για παράδειγμα, και ποτέ προσθήκη γιατί οι δεσμοί σίγμα μεταξύ των ατόμων άνθρακα τους είναι εξαιρετικά σταθερός.
Οι αντιδράσεις προσθήκης που μπορούν να συμβούν με τα κυκλοαλκάνια είναι βασικά όλες, αλλά με το κυκλοπεντάνιο οι μόνες που μπορεί να υποστεί είναι η υδρογόνωση και η αλογόνωση. Ακολουθούν παραδείγματα προσθηκών με κυκλοαλκάνια και οι συνθήκες εμφάνισής τους:
α) Υδρογόνωση
Αντίδραση του κυκλοαλκανίου με το μόριο υδρογόνου με την παρουσία κονιοποιημένου μεταλλικού καταλύτη (ψευδάργυρος, νικέλιο ή πλατίνα) παρουσία θέρμανσης (περίπου 180°CΟΝΤΟ). Σε αυτή την αντίδραση, το κυκλοαλκάνιο θα δώσει α αλκάνιο. Σε αυτή την αντίδραση, αφού σπάσει ο κύκλος, προστίθεται ένα άτομο υδρογόνου σε καθέναν από τους άνθρακες του δεσμού σίγμα που διασπάστηκε.

Αντίδραση προσθήκης σε κυκλοβουτάνιο με χρήση υδρογόνου
β) Αλογόνωση
Αντίδραση του κυκλοαλκανίου με το μόριο αλογόνου (π.χ. χλώριο, βρώμιο, ιώδιο) με την παρουσία καταλύτη χλωριούχου σιδήρου III (FeCl3). Σε αυτή την αντίδραση, το κυκλοαλκάνιο θα δώσει α οργανικό αλογονίδιο με δύο άτομα αλογόνου στην αλυσίδα. Αφού σπάσει ο κύκλος, έχουμε την προσθήκη ενός ατόμου αλογόνου σε καθέναν από τους άνθρακες του δεσμού σίγμα που διασπάστηκε.

Αντίδραση προσθήκης σε κυκλοβουτάνιο με χρήση βρωμίου
γ) Αντίδραση με αλογονοϋδρίδια (αλογονίδια οξέων)
Αντίδραση του κυκλοαλκανίου με το μόριο ανόργανου ένυδρου που περιέχει αλογόνο (HCl. HBr, HI). Καθώς ένα οξύ χρησιμοποιείται ως αντιδρών, δεν χρησιμοποιείται καταλύτης. Σε αυτή την αντίδραση, το κυκλοαλκάνιο θα δώσει α οργανικό αλογονίδιο με ένα μόνο άτομο αλογόνου στην αλυσίδα. Μετά τη διακοπή του κύκλου έχουμε την προσθήκη ενός ατόμου υδρογόνου σε έναν από τους άνθρακες του δεσμού σίγμα που διασπάστηκε και ενός αλογόνου στον άλλο άνθρακα. Υπακούοντας στον κανόνα του Markovnikov (H στον περισσότερο υδρογονωμένο άνθρακα και αλογόνο στον λιγότερο υδρογονωμένο άνθρακα).
Σημείωση: Εμφανίζεται μόνο με κυκλοπροπάνιο και κυκλοβουτάνιο.
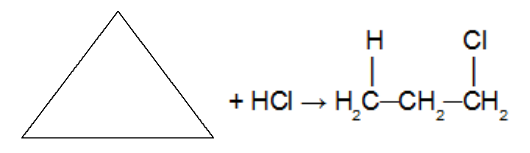
Αντίδραση προσθήκης σε κυκλοπροπάνιο με χρήση υδροχλωρικού οξέος
Σημείωση: Εμφανίζεται μόνο με κυκλοπροπάνιο και κυκλοβουτάνιο.
δ) Ενυδάτωση
Αντίδραση κυκλοαλκανίου με μόριο νερού παρουσία θειικού οξέος και θέρμανση. Σε αυτή την αντίδραση, το κυκλοαλκάνιο θα δώσει α μονο αλκοόλ (οινόπνευμα με μόνο μία ομάδα ΟΗ στην αλυσίδα). Μετά τη διακοπή του κύκλου έχουμε την προσθήκη ενός ατόμου υδρογόνου σε έναν από τους άνθρακες του δεσμού σίγμα που διασπάστηκε και ενός υδροξυλίου (ΟΗ) στον άλλο άνθρακα. Υπακούοντας στον κανόνα του Markovnikov (H στον περισσότερο υδρογονωμένο άνθρακα και υδροξύλιο στον λιγότερο υδρογονωμένο άνθρακα).
Σημείωση: Εμφανίζεται μόνο με κυκλοπροπάνιο και κυκλοβουτάνιο.

Αντίδραση προσθήκης σε κυκλοπροπάνιο με χρήση υδροχλωρικού οξέος
Από εμένα Diogo Lopes Dias
Πηγή: Σχολείο Βραζιλίας - https://brasilescola.uol.com.br/quimica/adicoes-ciclanos.htm
