Η διαλυμένη ουσία και ο διαλύτης είναι τα δύο συστατικά ενός ομοιογενούς μείγματος που ονομάζεται χημικό διάλυμα.
- Διαλυτό: είναι η ουσία που διασπείρεται στο διαλύτη. Αντιστοιχεί στην ουσία που θα διαλυθεί και, γενικά, εμφανίζεται σε μικρότερη ποσότητα στο διάλυμα.
- Διαλυτικό μέσο: είναι η ουσία στην οποία η διαλυμένη ουσία θα διαλυθεί για να σχηματίσει ένα νέο προϊόν. Εμφανίζεται σε μεγαλύτερη ποσότητα στη λύση.
Η διάλυση μεταξύ της διαλυμένης ουσίας (διεσπαρμένη) και του διαλύτη (διασποράς) λαμβάνει χώρα μέσω αλληλεπιδράσεων μεταξύ των μορίων τους.
Η διαφορά μεταξύ αυτών των δύο συστατικών ενός διαλύματος είναι ότι η διαλυμένη ουσία είναι η ουσία που θα διαλυθεί και ο διαλύτης είναι η ουσία που θα επηρεάσει τη διάλυση.
Ο πιο γνωστός διαλύτης είναι το νερό, θεωρείται το καθολικός διαλύτης. Αυτό συμβαίνει επειδή έχει τη δυνατότητα να διαλύσει μια μεγάλη ποσότητα ουσιών.
Παραδείγματα διαλυτών και διαλυτών
Δείτε μερικά παραδείγματα χημικών διαλυμάτων και ανακαλύψτε τις διαλυτικές ουσίες και τους διαλύτες καθεμιάς από αυτές:
Νερό και αλάτι
- Διαλυμένη ουσία: Επιτραπέζιο αλάτι - Χλωριούχο νάτριο (NaCl)
- Διαλύτης: Νερό
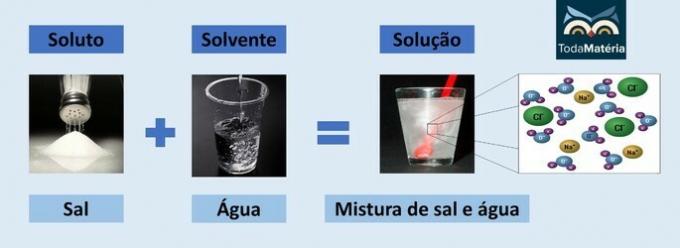
Καθώς είναι μια ιοντική ένωση, το χλωριούχο νάτριο στο διάλυμα διαχωρίζεται και σχηματίζει ιόντα τα οποία, με τη σειρά τους, διαλύονται από μόρια Νερό.
Ο θετικός πόλος του νερού (H+) αλληλεπιδρά με το ανιόν του αλατιού (Cl-) και τον αρνητικό πόλο νερού (O2-) αλληλεπιδρά με το κατιόν (Na+).
Αυτός είναι ένας τύπος ηλεκτρολυτικού διαλύματος, καθώς τα ιοντικά είδη σε διάλυμα είναι ικανά να μεταφέρουν ηλεκτρικό ρεύμα.
νερό και ζάχαρη
- Διαλυμένη ουσία: Ζάχαρη - Σακχαρόζη (Γ12Η22Ο11)
- Διαλύτης: Νερό

Η ζάχαρη είναι μια ομοιοπολική ένωση και όταν διαλύεται σε νερό μόρια διασκορπίζονται αλλά δεν αλλάζουν την ταυτότητά τους.
Αυτό το υδατικό διάλυμα ταξινομείται ως μη ηλεκτρολυτικό, καθώς η διαλυμένη ουσία στο διάλυμα είναι ουδέτερη και, επομένως, δεν αντιδρά με νερό.
Ξύδι
- Διαλυμένη ουσία: Οξικό οξύ (CH3COOH)
- Διαλύτης: Νερό

Το ξίδι είναι ένα διάλυμα που περιέχει τουλάχιστον 4% οξικό οξύ, α καρβοξυλικό οξύ το οποίο, ως πολικό, αλληλεπιδρά με το νερό, επίσης πολικό, μέσω δεσμών υδρογόνου.
Ένας σημαντικός κανόνας για τη διαλυτότητα είναι αυτός που διαλύεται σαν. Οι πολικές ενώσεις διαλύονται σε πολικούς διαλύτες, ενώ οι μη πολικές ουσίες διαλύονται σε μη πολικούς διαλύτες.
Άλλες λύσεις
Εκτός από τα υγρά διαλύματα, υπάρχουν επίσης αέρια και στερεά διαλύματα.
Ο αέρας που αναπνέουμε είναι ένα παράδειγμα αέριου διαλύματος, του οποίου τα αέρια σε μεγαλύτερη ποσότητα είναι άζωτο (78%) και οξυγόνο (21%).
Στο μεταλλικά κράματα είναι σταθερές λύσεις. Για παράδειγμα, ο ορείχαλκος (ψευδάργυρος και χαλκός) είναι ένα μείγμα που χρησιμοποιείται για την κατασκευή μουσικών οργάνων.
Θέλετε να αποκτήσετε περισσότερες γνώσεις; Διαβάστε λοιπόν αυτά τα άλλα κείμενα:
- Χημικά διαλύματα
- διαμοριακές δυνάμεις
- Ομοιογενή και ετερογενή μίγματα
Ποιος είναι ο Συντελεστής Διαλυτότητας;
Ο συντελεστής διαλυτότητας είναι το όριο της διαλυμένης ουσίας που προστίθεται στον διαλύτη σε μια δεδομένη θερμοκρασία για να σχηματιστεί ένα κορεσμένο διάλυμα.
Ο συντελεστής διαλυτότητας ποικίλλει ανάλογα με τις συνθήκες και μπορεί να αυξηθεί ή να μειωθεί με αλλαγές στη θερμοκρασία και την εν λόγω διαλυμένη ουσία.
Υπάρχει ένα όριο στο οποίο ο διαλύτης μπορεί να πραγματοποιήσει διάλυση.
Παράδειγμα: Εάν βάζετε ζάχαρη σε ένα ποτήρι νερό, την πρώτη στιγμή, θα παρατηρήσετε ότι η ζάχαρη εξαφανίζεται στο νερό.
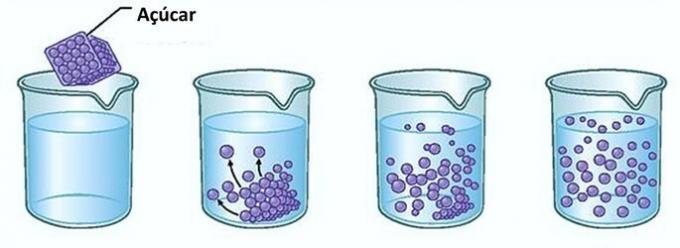
Ωστόσο, εάν συνεχίσετε να προσθέτετε ζάχαρη, θα διαπιστώσετε ότι κάποια στιγμή θα αρχίσει να συσσωρεύεται στο κάτω μέρος του ποτηριού.
Αυτό συμβαίνει επειδή το νερό, που είναι ο διαλύτης, έχει φτάσει το όριο του διαλυτότητα και το μέγιστο ποσό συγκέντρωσης. Η διαλυμένη ουσία που παραμένει στο κάτω μέρος του δοχείου και δεν διαλύεται ονομάζεται φόντο του σώματος.
Η περίσσεια ζάχαρης στο κάτω μέρος του γυαλιού δεν διαλύεται και δεν επηρεάζει τη συγκέντρωση του διαλύματος. Επιπλέον, η ζάχαρη που εναποτίθεται στο κάτω μέρος του ποτηριού δεν θα κάνει το νερό πιο γλυκό.
Ταξινόμηση λύσεων
Τα διαλύματα μπορούν να ταξινομηθούν με βάση την ποσότητα διαλυμένης διαλυμένης ουσίας. Έτσι, μπορούν να είναι τριών τύπων: κορεσμένα, ακόρεστα και υπερκορεσμένα.
- κορεσμένο διάλυμα: Το διάλυμα έχει φτάσει στο όριο του συντελεστή διαλυτότητας, δηλαδή, υπάρχει μια μέγιστη ποσότητα διαλυμένης ουσίας διαλυμένης στον διαλύτη σε μια συγκεκριμένη θερμοκρασία.
- ακόρεστο διάλυμα: Η ποσότητα διαλυμένης διαλυμένης ουσίας δεν έχει ακόμη φτάσει τον συντελεστή διαλυτότητας. Αυτό σημαίνει ότι μπορεί να προστεθεί περισσότερη διαλυμένη ουσία.
- υπερκορεσμένο διάλυμα: Υπάρχει περισσότερο διαλυμένη διαλυμένη ουσία απ 'ότι υπό κανονικές συνθήκες. Σε αυτήν την περίπτωση, παρουσιάζουν ένα ίζημα.
Για να μάθετε περισσότερα σχετικά με τις λύσεις, διαβάστε τα ακόλουθα κείμενα.:
- Αραίωση διαλυμάτων
- Μοριακότητα
- Μοριακότητα
- Ογκομετρική ανάλυση
Συγκέντρωση λύσεων
Από τη διαλυμένη ουσία και τον διαλύτη είναι δυνατόν να υπολογιστεί η συγκέντρωση ενός διαλύματος.
Η κοινή συγκέντρωση ορίζεται ως η αναλογία της μάζας της διαλυμένης ουσίας σε δεδομένο όγκο διαλύματος.
Ο υπολογισμός της συγκέντρωσης γίνεται με τον ακόλουθο τύπο:
Να εισαι,
ΝΤΟ: Συγκέντρωση (g / L);
Μ: μάζα διαλυμένης ουσίας (g) ·
Β: όγκος διαλύματος (L).
Παράδειγμα:
(Faap) Υπολογίστε τη συγκέντρωση, σε g / L, ενός υδατικού διαλύματος νιτρικού νατρίου που περιέχει 30 g αλατιού σε 400 mL διαλύματος:
Ανάλυση:
Παρατηρήστε τις πληροφορίες σχετικά με τις ποσότητες διαλυμένης ουσίας και διαλύτη. Υπάρχουν 30 g άλατος (διαλυμένη ουσία) σε 400 mL υδατικού διαλύματος (διαλύτης).
Ωστόσο, ο όγκος είναι σε mL και πρέπει να τον μετατρέψουμε σε L:
Τώρα, για να γνωρίζετε τη συγκέντρωση, πρέπει απλώς να εφαρμόσετε τον τύπο:
Με αυτό το αποτέλεσμα, καταλήξαμε στο συμπέρασμα ότι όταν αναμιγνύουμε 30 g αλατιού με 400 mL νερού, θα πάρουμε ένα διάλυμα με συγκέντρωση 75 g / L.
Για περισσότερες πληροφορίες σχετικά με τον τρόπο υπολογισμού της κοινής συγκέντρωσης, αυτά τα κείμενα θα είναι χρήσιμα.:
- Συγκέντρωση λύσης
- Ασκήσεις για κοινή συγκέντρωση


