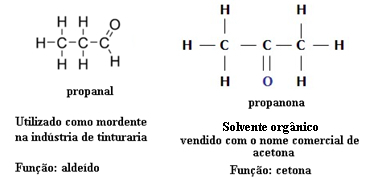
Εσείς οξείδια είναι δυαδικές ενώσεις (αποτελούμενες από δύο χημικά στοιχεία) όπου άτομα οξυγόνου συνδέονται με άλλα στοιχεία.
Ενας ιοντικό οξείδιο σχηματίζεται από την ένωση οξυγόνου με ένα μέταλλο, ήδη σε ένα μοριακό οξείδιο, το οξυγόνο ενώνει ένα μη μεταλλικό.
Μερικά παραδείγματα οξειδίων είναι: σκουριά (οξείδιο του σιδήρου III), υπεροξείδιο του υδρογόνου (υπεροξείδιο του υδρογόνου), ασβέστης (οξείδιο του ασβεστίου) και διοξείδιο του άνθρακα (διοξείδιο του άνθρακα).
Από αυτό, ανάλογα με τη συμπεριφορά ορισμένων οξειδίων, ταξινομούνται σε:
| οξείδια οξέος | (αμετάλ + οξυγόνο) |
|---|---|
| Βασικά οξείδια | (μέταλλο + οξυγόνο) |
| Ουδέτερα οξείδια | (αμετάλ + οξυγόνο) |
| Αμφοτερικά Οξείδια | (ανυδρίτες ή βασικά οξείδια) |
| μικτά οξείδια | (οξείδιο + οξείδιο) |
| Υπεροξείδια | (οξυγόνο + οξυγόνο) |
Ταξινόμηση των Οξειδίων
Οξείδια οξέων (ανυδρίτες)
Σχηματισμένα από μη μέταλλα, οξείδια οξέος έχουν έναν ομοιοπολικό χαρακτήρα, και παρουσία νερού που παράγουν αυτές οι ενώσεις οξέα και, από την άλλη πλευρά, παρουσία βάσεων σχηματίζουν αλάτι και νερό.
Παραδείγματα:
- CO2 (διοξείδιο του άνθρακα ή διοξείδιο του άνθρακα)
- ΜΟΝΟ2 (διοξείδιο του θείου)
Βασικά οξείδια
Σχηματίζεται από μέταλλα, τα βασικά οξείδια έχουν ιοντικό χαρακτήρα και όταν αντιδρούν με οξέα που σχηματίζονται άλας και νερό.
Παραδείγματα:
- Στο2O (οξείδιο του νατρίου)
- CaO (οξείδιο του ασβεστίου)
Ουδέτερα οξείδια
Σχηματίζεται από μη μέταλλα, ουδέτερα οξείδια, που ονομάζονται επίσης «αδρανή οξείδια», έχουν ομοιοπολικό χαρακτήρα και λαμβάνουν αυτό το όνομα επειδή δεν αντιδρούν παρουσία νερού, οξέων ή βάσεων.
Παραδείγματα:
- Ν2O (οξείδιο του αζώτου)
- CO (μονοξείδιο του άνθρακα)
Αμφοτερικά Οξείδια
Σε αυτήν την περίπτωση, τα οξείδια έχουν μια ιδιαιτερότητα, μερικές φορές συμπεριφέρονται ως ανυδρίτες (οξείδια οξέος), μερικές φορές ως βασικά οξείδια.
Με άλλα λόγια, αυτές οι ενώσεις παρουσία οξέος συμπεριφέρονται ως βασικά οξείδια και, αφετέρου, παρουσία βάση, αντιδρά ως οξείδια οξέος.
Παραδείγματα:
- Αλ2Ο3 (οξείδιο αργιλίου)
- ZnO (οξείδιο του ψευδαργύρου)
μικτά οξείδια
Σε αυτήν την περίπτωση, τα μικτά οξείδια, διπλά ή αλατούχα, προέρχονται από το συνδυασμό δύο οξειδίων.
Παραδείγματα:
- Πίστη3Ο4 (τετραοξείδιο τριφερόνης ή μαγνητική πέτρα)
- Pb3Ο4 (τετραοξείδιο του τριλάδιου)
Υπεροξείδια
Σχηματίζονται κυρίως από υδρογόνο, αλκαλικά μέταλλα και μέταλλα αλκαλικών γαιών.
Τα υπεροξείδια είναι ουσίες που αποτελούνται από δύο άτομα οξυγόνου που συνδέονται μεταξύ τους και, συνεπώς, έχουν την ομάδα (Ο) στον τύπο τους.2)2-.
Παραδείγματα:
- Η2Ο2 (υπεροξείδιο του υδρογόνου ή υπεροξείδιο του υδρογόνου)
- Στο2Ο2 (υπεροξείδιο του νατρίου)
Διαβάστε επίσης: Ανόργανες λειτουργίες
Παραδείγματα Οξειδίων
| CO | μονοξείδιο του άνθρακα |
|---|---|
| CO2 | διοξείδιο του άνθρακα |
| Η2Ο | Νερό ή οξείδιο του υδρογόνου |
| Κλ2Ο7 | επταξείδιο του διχλωρίου |
| Στο2Ο | οξείδιο του νατρίου |
| ανάγνωση2Ο | οξείδιο του λιθίου |
| Σκύλος | οξείδιο του ασβεστίου |
| Καλός | οξείδιο του βαρίου |
| ΦΕΟ | οξείδιο του σιδήρου II ή οξείδιο του σιδήρου |
| Πίστη2Ο3 | οξείδιο του σιδήρου III ή οξείδιο του σιδήρου |
| ZnO | οξείδιο του ψευδαργύρου |
| Αλ2Ο3 | οξείδιο αργιλίου |
| ΜΝΟ2 | διοξείδιο του μαγγανίου |
| Θείος2 | διοξείδιο τιτανίου |
| Σνο2 | διοξείδιο του κασσιτέρου |
| ΣΤΟ2 | διοξείδιο του αζώτου |
| Σημ2Ο5 | οξείδιο νιοβίου V |
Χαρακτηριστικά οξειδίου
- Είναι δυαδικές ουσίες.
- Έχετε γενικό τύπο Γ2Οε, όπου y είναι η επιβάρυνση του κατιόντος (Cγ +);
- Στα οξείδια, το οξυγόνο είναι το πιο ηλεκτροαρνητικό στοιχείο.
- Σχηματίζονται με τη σύνδεση του οξυγόνου με άλλα στοιχεία, εκτός από το φθόριο.
Διαβάστε επίσης: Χημικές λειτουργίες
Κύρια οξείδια και εφαρμογές τους
Δείτε παρακάτω πού χρησιμοποιούνται ορισμένα οξείδια:

Ονοματολογία οξειδίων
Γενικά, η ονοματολογία ενός οξειδίου ακολουθεί την ακόλουθη σειρά:
+ Στοιχείο με όνομα οξείδιο σε συνδυασμό με οξυγόνο
| Ονομασία ανάλογα με τον τύπο οξειδίου | |
|---|---|
| ιοντικά οξείδια |
Παραδείγματα οξειδίων σταθερού φορτίου: CaO - οξείδιο του ασβεστίου Αλ2Ο3 - οξείδιο αργιλίου |
|
Παραδείγματα οξειδίων με μεταβλητό φορτίο: FeO - Οξείδιο του σιδήρου II Πίστη2Ο3 - Οξείδιο του σιδήρου III | |
| μοριακά οξείδια |
Παραδείγματα: CO - μονοξείδιο του άνθρακα Ν2Ο5 - Πεντοξείδιο του αζώτου |
Περιέργειες
- Η όξινη βροχή είναι ένα φαινόμενο που προκαλείται από την ατμοσφαιρική ρύπανση. Έτσι, ορισμένα οξείδια που υπάρχουν στην ατμόσφαιρα είναι υπεύθυνα για την αύξηση της οξύτητας της βροχής, δηλαδή: οξείδια του θείου (SO2 και έτσι3) και οξείδια του αζώτου (Ν2Ο, ΟΧΙ και ΟΧΙ2).
- Οι δυαδικές ενώσεις του2 είναι το2φά2 δεν θεωρούνται οξείδια, καθώς το φθόριο είναι ένα περισσότερο ηλεκτροαρνητικό στοιχείο από το οξυγόνο.
- Αν και τα ευγενή αέρια είναι λίγο αντιδραστικά, υπό ειδικές συνθήκες είναι δυνατό να δημιουργηθούν οξείδια αυτής της οικογένειας, όπως το ξένων (XeO3 και XeO4).
Δοκιμάστε τις γνώσεις σας για τα οξείδια με ερωτήσεις για τις εισαγωγικές εξετάσεις και σχόλια από ειδικούς: Ασκήσεις σε ανόργανες λειτουργίες.