Εσείς αλδεϋδες και το κετόνες είναι πολύ παρόμοιες οργανικές λειτουργίες. Και οι δύο έχουν στη δομή τους τη λειτουργική ομάδα καρβονυλίου (C = O), με τη μόνη διαφορά που, στην περίπτωση του Αλδεϋδες, εμφανίζεται πάντα στο τέλος της ανθρακικής αλυσίδας, δηλαδή, ένας από τους καρβονυλ-συνδέτες άνθρακα είναι ο υδρογόνο; οι κετόνες έχουν το καρβονύλιο μεταξύ δύο άλλων ατόμων άνθρακα.
Λειτουργική ομάδα Aldehydes:Λειτουργική ομάδα κετονών:
Ο Ο
║ ║
Γ C ─ Η Γ C ─ Γ
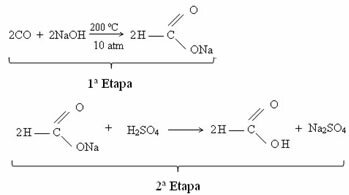
Για το λόγο αυτό, υπάρχουν περιπτώσεις λειτουργικού ισομερισμού μεταξύ αλδεϋδών και κετονών. Για παράδειγμα, παρακάτω παρουσιάζουμε δύο λειτουργικά ισομερή που έχουν τον ίδιο μοριακό τύπο (C3Η6Ο), αλλά το ένα είναι αλδεΰδη (προπανικό) και το άλλο είναι κετόνη (προπανόνη). Δείτε πώς αυτό αλλάζει εντελώς τις ιδιότητες και τις εφαρμογές τους:
Παράδειγμα ισομερισμού λειτουργίας μεταξύ αλδεΰδης και κετόνης
Φανταστείτε ότι βρίσκεστε σε εργαστήριο και βρείτε ένα φιαλίδιο με άχρωμο υγρό που έχει μόνο τον μοριακό τύπο C3Η6Ο. Τι θα κάνατε για να μάθετε εάν είναι κετόνη ή αλδεΰδη;
Για την επίλυση προβλημάτων όπως αυτό, Υπάρχουν μέθοδοι για τη διαφοροποίηση αλδεϋδών και κετονών με βάση την αντίδραση αυτών των ενώσεων έναντι ασθενών οξειδωτικών παραγόντων. Οπως φαίνεται παρακάτω, Όταν αντιμετωπίζουν ασθενή οξειδωτικά, οι αλδεΰδες αντιδρούν οξειδωμένα, ενώ οι κετόνες δεν αντιδρούν. Το λέμε αυτόΟι αλδεΰδες δρουν ως αναγωγικοί παράγοντες, αλλά οι κετόνες δεν το κάνουν, αντιδρούν μόνο ως αναγωγικοί παράγοντες σε επαφή με ενεργητικά οξειδωτικά.
Αλδεϋδες + Αδύναμοι Οξειδωτές → καρβοξυλικό οξύ
Ο Ο
║ ║
C ─ C ─ H + [O] → C ─ C ─ OH
Κετόνες + Ασθενείς Οξειδωτές → Μην αντιδράτε
Ο
║
C ─ C ─ C + [O] → Δεν εμφανίζεται αντίδραση
Με βάση αυτό, αρκεί τότε να πραγματοποιήσουμε αυτήν την αντίδραση και να δούμε αν η ένωση αντιδρά ή όχι. Εάν αντιδρά, ξέρουμε ότι είναι μια αλδεΰδη. αν δεν αντιδρά, είναι κετόνη.
Επιπλέον, τα προϊόντα που σχηματίζονται σε αυτές τις αντιδράσεις οξείδωσης αλδεϋδης είναι αρκετά ορατά, με αλλαγές χρώματος να συμβαίνουν, όπως θα φανεί αργότερα.
Υπάρχουν τρεις βασικές μέθοδοι διαφοροποίησης αλδεϋδών και κετονών, οι οποίες είναι:
1- Tollens Reactive: Αυτό το αντιδραστήριο είναι ένα διάλυμα αμμωνίας νιτρικού αργύρου, δηλαδή περιέχει νιτρικό άργυρο (AgNO3) και περίσσεια υδροξειδίου του αμμωνίου (NH4ΟΗ):
ΑΓΝΟ3 + 3 ΝΗ4OH → Ag (ΝΗ3OH + ΝΗ4ΣΤΟ3 + 2 Ω2Ο
Tollens Reactive (πήρε το όνομά του από τον Γερμανό χημικό Bernhard Tollens (1841-1918))
Όπως εξηγείται στο κείμενο Κάνοντας έναν ασημένιο καθρέφτη, όταν μια αλδεΰδη έρθει σε επαφή με αντιδραστικά Tollens, οξειδώνεται στο αντίστοιχο καρβοξυλικό οξύ, ενώ τα ιόντα αργύρου μειώνονται σε Ag0 (μεταλλικό ασήμι). Εάν αυτή η αντίδραση πραγματοποιηθεί, για παράδειγμα, σε δοκιμαστικό σωλήνα, αυτός ο μεταλλικός άργυρος θα εναποτίθεται στα τοιχώματα του σωλήνα, με αποτέλεσμα το σχηματισμό ενός φιλμ που ονομάζεται ασημένιος καθρέφτης. Αυτό το αποτέλεσμα που παρατηρήθηκε είναι πολύ όμορφο και χρησιμοποιείται στη βιομηχανική διαδικασία κατασκευής καθρεφτών.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Η αντίδραση που λαμβάνει χώρα μπορεί να αναπαρασταθεί ως εξής:
Ο Ο
║ ║
R ─ C ─ H + H2O → R ─ C ─ OH + 2e- + 2 H+
2 Αγ+ + 2e- → 2 Ag0
2 ΝΗ3 + 2 Ω+ → 2 ΝΗ4+
Ο Ο
║║
R C ─ Η + 2 Αγ+ + 2 ΝΗ3 + Χ2Ο → R C ─ ΟΗ + 2 Αγ0 + 2 ΝΗ4+
αλδεγύδη Tollens αντιδραστικάκαρβοξυλικό οξύ μεταλλικό ασήμι (ασημί καθρέφτης)
Από την άλλη πλευρά, εάν βάλουμε την κετόνη να αντιδράσει με το Tollens αντιδραστικό, ο σχηματισμός μεταλλικού αργύρου δεν θα συμβεί, επειδή οι κετόνες δεν μπορούν να μειώσουν τα ιόντα.+.
2- Fehling Reactive: Αυτό το αντιδραστικό είναι ένα μπλε διάλυμα θειικού χαλκού II (CuSO4) σε ένα βασικό μέσο, καθώς αναμιγνύεται με ένα άλλο διάλυμα που σχηματίζεται από υδροξείδιο νατρίου (NaOH) και τρυγικό νάτριο και κάλιο (NaOOC-CHOH-CHOH-COOK). Το τρυγικό άλας προστίθεται στο διάλυμα θειικού χαλκού II για να το σταθεροποιήσει και να αποτρέψει την καταβύθισή του.
ΚΟΥΣΟ4 + 2 NaOH → Να2ΜΟΝΟ4 + Κου (ΟΗ)2
Fehling Reactive (πήρε το όνομά του από τον Γερμανό χημικό Hermann von Fehling (1812-1885))
Σε επαφή με το αντιδραστικό Fehling, μια αλδεΰδη σχηματίζει το καρβοξυλικό οξύ με την οξείδωση του, ενώ τα ιόντα χαλκού (Cu)2+) που υπάρχουν στη μέση μειώνονται, σχηματίζοντας ένα κοκκινωπό καφέ ίζημα (περισσότερο σαν τούβλο), το οποίο είναι οξείδιο του χαλκού. Οι κετόνες, από την άλλη πλευρά, δεν αντιδρούν - επειδή δεν μπορούν να μειώσουν τα ιόντα2+.
Ο Ο
║ ║
R ─ C ─ H + 2 Cu (OH)2 → R ─ C ─ OH + Γάιδαρος2Ο + 2 Ω2Ο
αλδεγύδη κοκκινωπό-καφέ ίζημα
3- Reactive του Benedict: Αυτό το αντιδραστικό σχηματίζεται επίσης από ένα διάλυμα θειικού χαλκού II (Cu (OH)2) σε βασικό μέσο, αλλά αναμιγνύεται με κιτρικό νάτριο.
Όπως και με το αντιδραστήριο του Fehling, στην περίπτωση της αντίδρασης μεταξύ της αλδεΰδης και του αντιδραστηρίου του Benedict, υπάρχουν επίσης ιόντα χαλκού (Cu2+) παρόν στο μέσο που είναι αναγωγικά και σχηματίζουν κόκκινο οξείδιο του χαλκού.
Αυτό το αντιδραστήριο χρησιμοποιείται ευρέως σε δοκιμές για την ανίχνευση της παρουσίας και της περιεκτικότητας σε γλυκόζη στα ούρα. Η γλυκόζη έχει μια ομάδα αλδεϋδης στη δομή της, οπότε αντιδρά με το αντιδραστήριο Benedict που υπάρχει σε ταινίες για αυτές τις δοκιμές. Από εκεί, απλώς συγκρίνετε το χρώμα της κορδέλας με το χρώμα της κλίμακας στη συσκευασία του προϊόντος.

Το αντιδραστήριο Benedict χρησιμοποιείται για τον προσδιορισμό της περιεκτικότητας σε γλυκόζη στα ούρα.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Διαφοροποίηση αλδεϋδών και κετονών" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/diferenciacao-aldeidos-cetonas.htm. Πρόσβαση στις 27 Ιουνίου 2021.
Χημεία

Αλδεΰδες, καρβονυλικές ενώσεις, καρβονυλ ομάδα, κύριες αλδεϋδες, αιθανόλη, πρώτες ύλες στη βιομηχανία φυτοφαρμάκων και φαρμάκων, Metanal, φορμαλδεΰδη, πλαστικά και ρητίνη.
Χημεία

Κετόνες, οργανικές ουσίες, καρβονυλική λειτουργική ομάδα, λήψη διαλύτη σμάλτου, προπανόνη, κετονικά σώματα στην κυκλοφορία του αίματος, εκχύλιση ελαίων και λιπών από φυτικούς σπόρους, διαλύτες Οργανικός.