“Ο χημικός δεσμός »ήταν ένας όρος που χρησιμοποιήθηκε για πρώτη φορά από τον Gilbert Newton Lewis το 1920 σε ένα άρθρο για να εξηγήσει γιατί ότι τα άτομα κολλάνε για να σχηματίσουν ουσίες και επίσης γιατί κολλάνε πάνω από χιλιάδες χρονών.
Τα άτομα των περισσότερων χημικών στοιχείων που μέχρι σήμερα είναι γνωστά και αναφέρονται στον Περιοδικό Πίνακα δεν εμφανίζονται σε μεμονωμένη μορφή στη φύση. Τα περισσότερα από τα υλικά που υπάρχουν στην καθημερινή μας ζωή είναι ουσίες που μπορούν να είναι απλές (αποτελούμενες από άτομα μόνο ενός τύπου χημικού στοιχείου) ή σύνθετων υλικών (έχουν άτομα δύο ή περισσοτέρων χημικών στοιχείων πολλά διαφορετικά).
Αυτό συμβαίνει επειδή τα άτομα έχουν την ικανότητα να δημιουργούν χημικούς δεσμούς με άλλα άτομα, τα οποία μπορεί να είναι το ίδιο στοιχείο ή διαφορετικά στοιχεία. Αυτοί οι δεσμοί είναι τόσο ισχυροί που χωρίς εξωτερική επιρροή, στις περισσότερες περιπτώσεις τα άτομα θα παραμείνουν ενωμένα όπως είναι.
Χάρτης μυαλού: Χημικά ομόλογα

* Για να κατεβάσετε τον χάρτη μυαλού σε PDF, Κάντε κλικ ΕΔΩ!
Για παράδειγμα, δεν είναι συνηθισμένο να βρούμε ένα άτομο ελεύθερου οξυγόνου στη φύση. Ωστόσο, βρίσκουμε πολλές ουσίες στις οποίες φαίνεται να συνδέονται με άλλα άτομα. Ένα παράδειγμα μιας απλής ουσίας είναι το αέριο οξυγόνο στο οποίο κάθε μόριο σχηματίζεται από δύο συνδεδεμένα άτομα οξυγόνου (Ο2); ενώ ένα παράδειγμα σύνθετης ουσίας είναι το νερό, όπου κάθε μόριο έχει δύο άτομα υδρογόνου συνδεδεμένα με ένα άτομο οξυγόνου (H2Ο).
Τα μόνα στοιχεία που βρίσκονται σταθερά απομονωμένα στη φύση είναι τα ευγενή αέρια, δηλαδή, τα στοιχεία της οικογένειας 18 του Περιοδικού Πίνακα (He, Ne, Ar, Kr, Xe και Rn). Όλα αυτά τα στοιχεία έχουν από κοινού το γεγονός ότι έχουν οκτώ ηλεκτρόνια στο τελευταίο κέλυφος ηλεκτρονίων (στρώμα σθένους), με εξαίρεση το ήλιο (He), που έχει μόνο ένα κέλυφος ηλεκτρονίων (στρώμα Κ) και επομένως κρατά δύο ηλεκτρόνια, που είναι ο μέγιστος δυνατός αριθμός ηλεκτρονίων σε αυτό στρώμα.
Έτσι, ο Gilbert N. Ο Lewis και ο επιστήμονας Water Kossel κατέληξαν στο συμπέρασμα ότι τα άτομα των άλλων στοιχείων δεσμεύονται να έχουν οκτώ ηλεκτρόνια (ή δύο, εάν έχετε μόνο το κέλυφος Κ) και έτσι σταθεροποιούνται. Δημιουργήθηκε, λοιπόν, το ηλεκτρονική θεωρία του σθένους, που δείχνει πόσους χημικούς δεσμούς δημιουργεί το άτομο ενός στοιχείου, με βάση την εξηγηθείσα ιδέα.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Ως εκ τούτου, τα άτομα δημιουργούν χημικούς δεσμούς, επιδιώκοντας να χάσουν, να αποκτήσουν ή να μοιραστούν ηλεκτρόνια κελύφους σθένους έως ότου φθάσουν στη διαμόρφωση του επόμενου ευγενούς αερίου.Αυτή η θεωρία έγινε επίσης γνωστή κανόνας οκτάδας.
Για παράδειγμα, το οξυγόνο είναι δισθενές επειδή έχει έξι ηλεκτρόνια στο κέλυφος του σθένους. Επομένως, πρέπει να λάβει δύο ακόμη ηλεκτρόνια για να έχει μια διαμόρφωση του νέου ευγενούς αερίου (Ne), δηλαδή, με οκτώ ηλεκτρόνια στο κέλυφος σθένους, το οποίο στην περίπτωση αυτή είναι το κελύφος L. Στην περίπτωση του αναφερόμενου αερίου οξυγόνου και νερού, έχουμε τα εξής:
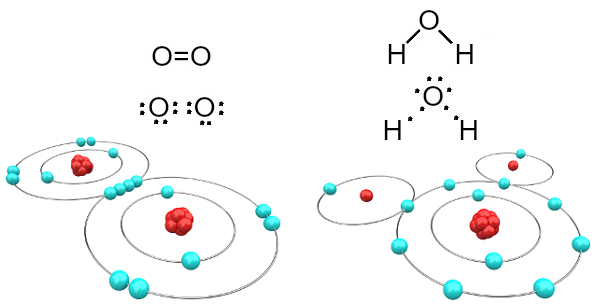
Μόρια οξυγόνου και νερού που σχηματίζονται από ομοιοπολικούς δεσμούς
Σημειώστε ότι στην πρώτη περίπτωση (αέριο οξυγόνο - O2), κάθε άτομο οξυγόνου μοιράζεται δύο ηλεκτρόνια, και τα δύο έχουν οκτώ ηλεκτρόνια στο κέλυφος σθένους. Αυτό σημαίνει ότι a διπλός δεσμός (δύο δεσμοί ταυτόχρονα μεταξύ δύο ατόμων).
Στην περίπτωση του νερού, καθένα από τα δύο άτομα υδρογόνου μοιράζεται ένα ηλεκτρόνιο με το κεντρικό άτομο οξυγόνου και όλα είναι σταθερά (το οξυγόνο έχει οκτώ ηλεκτρόνια στο κέλυφος σθένους και κάθε υδρογόνο έχει δύο ηλεκτρόνια). Εδώ γίνονται επίσης δύο απλές συνδέσεις.
Αυτός ο τύπος χημικού δεσμού, στον οποίο όλα τα άτομα πρέπει να δέχονται ηλεκτρόνια (υδρογόνο, μη μέταλλα και ημιμέταλλα) και στον οποίο τα ηλεκτρόνια μοιράζονται σε ζεύγη, ονομάζεται ομοιοπολικό δεσμό.
Υπάρχουν όμως δύο ακόμη τύποι χημικών δεσμών:
(1) ιοντικός δεσμός → υπάρχει η οριστική μεταφορά ηλεκτρονίων από το ένα άτομο στο άλλο. Αυτός ο τύπος συγκόλλησης συμβαίνει μεταξύ μεταλλικών ατόμων (τα οποία έχουν την τάση να χάνουν ηλεκτρόνια για να παραμείνουν σταθερό) και άτομα υδρογόνου, μη μέταλλα και ημι μέταλλα (τα οποία έχουν την τάση να αποκτούν ηλεκτρόνια για να παραμένουν σταθερός).
Ένα παράδειγμα είναι το χλωριούχο νάτριο (NaCl - επιτραπέζιο άλας) όπου το νάτριο είναι ένα μέταλλο που έχει την τάση να χάσει ένα ηλεκτρόνιο, ενώ το χλώριο είναι ένα μη μέταλλο που έχει την τάση να αποκτά ένα ηλεκτρόνιο. Έτσι, το νάτριο δίνει(κόκκινο βέλος)ένα ηλεκτρόνιο προς χλώριο, σχηματίζοντας αλάτι, μια πολύ σταθερή ουσία. Από τότε που αποφοιτούν (μαύρο βέλος) ιόντα, τα οποία είναι χημικά είδη με αντίθετα φορτία (+ και -), ένα ιόν προσελκύει ένα άλλο κοντινό και σχηματίζονται ιονικές συστάδες με τεράστιο αριθμό ιόντων, όπως και οι κρύσταλλοι σε επιτραπέζιο αλάτι.

Σχηματισμός χλωριούχου νατρίου μέσω ιοντικής σύνδεσης
(2) Μεταλλική σύνδεση → Είναι μια θεωρία ότι τα μέταλλα (όπως αλουμίνιο, χρυσός, ασήμι, χαλκός κ.λπ.) σχηματίζονται από ένα σύμπλεγμα ατόμων νετρονίων και κατιόντα που συγκρατούνται μαζί από ένα είδος "νέφους" ελεύθερων ηλεκτρονίων (ηλεκτρόνια που χάθηκαν κατά το σχηματισμό κατιόντων αναφέρεται). Αυτό το νέφος (ή θάλασσα) ηλεκτρονίων θα λειτουργούσε ως μεταλλικός δεσμός που θα συγκρατούσε τα άτομα μαζί.
Για περισσότερες λεπτομέρειες σχετικά με αυτούς τους τύπους χημικών δεσμών, καθώς και για τον κανόνα οκτάδας, διαβάστε τα σχετικά άρθρα παρακάτω.
Χάρτης μυαλού του M.e Victor Ricardo Ferrreira
Καθηγητής Χημείας
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Χημεία

Ιονικός δεσμός, διευθετήσεις μεταξύ ιοντικών ενώσεων, ιοντικών συσσωματωμάτων, χλωριούχου νατρίου, επιτραπέζιου άλατος, ιοντικής ουσίας, ηλεκτροστατικές δυνάμεις έλξης, ανιόντα χλωρίου, κατιόντα νατρίου, πολικοί διαλύτες, θετικά ιόντα, κατιόντα, αρνητικά ιόντα, ανιόντα.