Ηλεκτρόλυση είναι μια φυσική-χημική διαδικασία που χρησιμοποιεί ηλεκτρική ενέργεια από οποιαδήποτε πηγή (όπως μπαταρία ή μπαταρία) για να αναγκάσει την εμφάνιση μιας χημικής αντίδρασης να παράγει απλές ή σύνθετες ουσίες που δεν μπορούν να βρεθούν στη φύση ή που δεν βρίσκονται σε μεγάλες ποσότητες.
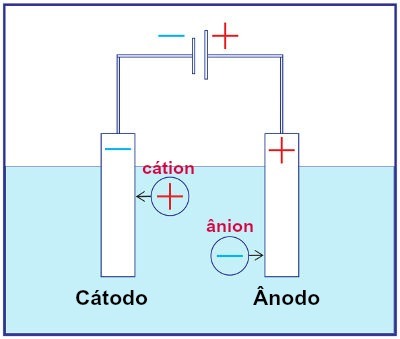
Αναπαράσταση της συναρμολόγησης οποιουδήποτε συστήματος ηλεκτρόλυσης
Κατά τη διάρκεια της ηλεκτρόλυσης, ένα κατιόν υφίσταται αναγωγή στην κάθοδο και ένα ανιόν υφίσταται οξείδωση στην άνοδο. Αυτό συμβαίνει μέσω ηλεκτρικής εκφόρτισης που παρέχεται από εξωτερική πηγή. Έτσι, στην ηλεκτρόλυση, έχουμε μια μη αυθόρμητη αντίδραση οξείδωσης και αναγωγής.
Τώρα καταλάβετε τους δύο τρόπους με τους οποίους συμβαίνει η ηλεκτρόλυση:
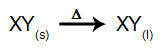
Σε αυτόν τον τύπο ηλεκτρόλυσης, χρησιμοποιούμε ένα ιοντική ουσία σε υγρή κατάσταση σε ηλεκτρολυτικό κάδο. Όταν η ιοντική ουσία (XY) υφίσταται σύντηξη, υποβάλλεται στη διαδικασία της διάσταση, όπως φαίνεται παρακάτω:

Στη συνέχεια, όταν η πηγή τροφοδοσίας είναι ενεργοποιημένη, το κατιόν (X+) κινείται προς την κάθοδο και τα ανιόντα (Υ-) προχωρήστε προς την άνοδο. Εκ τούτου:
Στην κάθοδο: τα κατιόντα λαμβάνουν ηλεκτρόνια (υφίστανται αναγωγή) και μετατρέπονται σε μια σταθερή ουσία (X), μια διαδικασία που αντιπροσωπεύεται από την ακόλουθη εξίσωση:
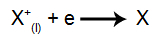
Στην άνοδο: τα ανιόντα χάνουν ηλεκτρόνια (υφίστανται οξείδωση) και γίνονται μια σταθερή ουσία (X), μια διαδικασία που αντιπροσωπεύεται από την ακόλουθη εξίσωση:

α) Παράδειγμα πυριτικής ηλεκτρόλυσης
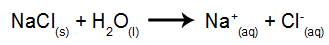
Για παράδειγμα, ακολουθήστε τώρα την πύρινη ηλεκτρόλυση του χλωριούχο νάτριο (NaCl). Όταν το χλωριούχο νάτριο (NaCl) υφίσταται σύντηξη, υποβάλλεται στη διαδικασία διαχωρισμού, όπως φαίνεται παρακάτω:
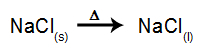
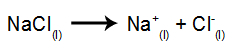
Στη συνέχεια, όταν η πηγή ισχύος είναι ενεργοποιημένη, το κατιόν (Na+) κινείται προς την κάθοδο και τα ανιόντα (Cl-) προχωρήστε προς την άνοδο. Εκ τούτου:
Στην κάθοδο: τα κατιόντα μέσα+ λαμβάνουν ηλεκτρόνια (υφίστανται αναγωγή) και γίνονται μια σταθερή ουσία (Na, που είναι ένα στερεό μέταλλο), μια διαδικασία που αντιπροσωπεύεται από την παρακάτω εξίσωση:

Στην άνοδο: τα ανιόντα Cl- χάνουν ηλεκτρόνια (υφίστανται οξείδωση) και γίνονται μια σταθερή ουσία (Cl2, η οποία είναι αέρια), διαδικασία που αντιπροσωπεύεται από την παρακάτω εξίσωση:

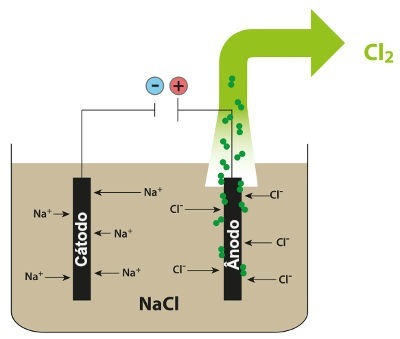
Σχήμα που δείχνει την πυριτική ηλεκτρόλυση του NaCl
Έτσι, στην πυριγενή ηλεκτρόλυση του χλωριούχου νατρίου, έχουμε το σχηματισμό μεταλλικού νατρίου (Na) και αερίου χλωρίου (Cl2).
Σε αυτόν τον τύπο ηλεκτρόλυσης, χρησιμοποιούμε μια ιοντική ουσία διαλυμένη στο νερό, μέσα στην ηλεκτρολυτική δεξαμενή. Έτσι, πριν πραγματοποιήσουμε την ηλεκτρόλυση, αναμιγνύουμε πρώτα την ουσία (συνήθως ένα αλάτι ανόργανο) στο νερό για να προκαλέσει τη διάσπασή του (απελευθέρωση κατιόντος και ανιόντος), όπως φαίνεται βελάζω:
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
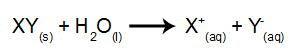
Η διαφορά σε σχέση με την πύρινη ηλεκτρόλυση είναι ότι, εκτός από τα ιόντα από τη διάσταση, έχουμε επίσης ιόντα από τον αυτο-ιονισμό του νερού. Στην αυτο-ιονισμό του, το νερό παράγει κατιόν υδρονίου (Η+) και ένα ανιόν υδροξειδίου (ΟΗ-), όπως στην παρακάτω εξίσωση:

Έτσι, μέσα στον ηλεκτρολυτικό κάδο, έχουμε την παρουσία δύο κατιόντων (ένα από την ουσία ιοντικό και ένα από το νερό) και δύο ανιόντα (το ένα από την ιοντική ουσία και το άλλο από το Νερό).
Για να μάθετε ποιο κατιόν θα μετακινηθεί στην κάθοδο και ποιο ανιόν θα κινηθεί στην άνοδο, είναι απαραίτητο να γνωρίζετε τη σειρά απόρριψης κατιόντων και ανιόντων.
Για κατιόντα:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> υδροδόνιο> οικογένεια IIIA> οικογένεια IIA> οικογένεια IA
για ανιόντα
Μη οξυγονωμένα ανιόντα και HSO4 > υδροξείδιο> οξυγονωμένα ανιόντα και F
Στη συνέχεια, όταν είναι ενεργοποιημένη η πηγή τροφοδοσίας, ένα κατιόν (X+) κινείται προς την κάθοδο και ένα από τα ανιόντα (Υ-) κινείται προς την άνοδο.
Στην κάθοδο: τα κατιόντα λαμβάνουν ηλεκτρόνια (υφίστανται αναγωγή) και μετατρέπονται σε μια σταθερή ουσία (X), μια διαδικασία που αντιπροσωπεύεται από την παρακάτω εξίσωση:

Στην άνοδο: τα ανιόντα χάνουν ηλεκτρόνια (υφίστανται οξείδωση) και μετατρέπονται σε μια σταθερή ουσία (Y), μια διαδικασία που αντιπροσωπεύεται από την παρακάτω εξίσωση:
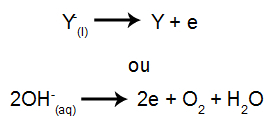
α) Παράδειγμα υδατικής ηλεκτρόλυσης
Για παράδειγμα, θα χρησιμοποιήσουμε την υδατική ηλεκτρόλυση χλωριούχου νατρίου (NaCl). Όταν το χλωριούχο νάτριο (NaCl) διαλύεται σε νερό, υποβάλλεται στη διαδικασία διαχωρισμού, όπως φαίνεται παρακάτω:
Εκτός από τη διάσπαση του NaCl, έχουμε τον αυτο-ιονισμό του νερού:

Έχουμε λοιπόν τα κατιόντα Η+ και συνεχώς+ και τα ανιόντα OH- και Cl-. Στη συνέχεια, όταν είναι ενεργοποιημένη η πηγή τροφοδοσίας, έχουμε τα εξής:
στην κάθοδο: τα κατιόντα Η+ λάβετε ηλεκτρόνια (μειωμένα) και γίνετε σταθερή ουσία (H2, που είναι αέριο). Αυτό συμβαίνει επειδή το υδρόνιο έχει προτεραιότητα εκφόρτισης έναντι των στοιχείων της οικογένειας IA (σε αυτήν την περίπτωση, Na). Η διαδικασία αντιπροσωπεύεται από την παρακάτω εξίσωση:
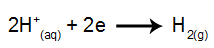
στην άνοδο: τα Cl ανιόντα- χάνουν ηλεκτρόνια (υφίστανται οξείδωση) και γίνονται μια σταθερή ουσία (Cl2, το οποίο είναι αέριο). Αυτό συμβαίνει επειδή το Cl- Είναι ένα μη οξυγονωμένο ανιόν και έχει προτεραιότητα εκφόρτισης έναντι του υδροξειδίου, μια διαδικασία που αντιπροσωπεύεται από την παρακάτω εξίσωση:


Σχήμα που δείχνει την υδατική ηλεκτρόλυση του NaCl
Έτσι, στην υδατική ηλεκτρόλυση του χλωριούχου νατρίου, έχουμε τον σχηματισμό αερίου υδρογόνου (Η2) και αέριο χλώριο (Cl2).
Από μένα. Diogo Lopes Dias
Χημεία

Εφαρμογές Ηλεκτρόλυσης, ηλεκτρολυτικής επιμετάλλωσης, επιμετάλλωσης νικελίου, επιχρωμίωσης, νικελίου, χρωμίου, καθόδου, νατρίου, αργιλίου, χλωρίου, καυστική σόδα, αέριο υδρογόνο, πυριτική ηλεκτρόλυση, υδατική ηλεκτρόλυση, αλκαλικά μέταλλα, αλκαλική γη, αέριο χλώριο.