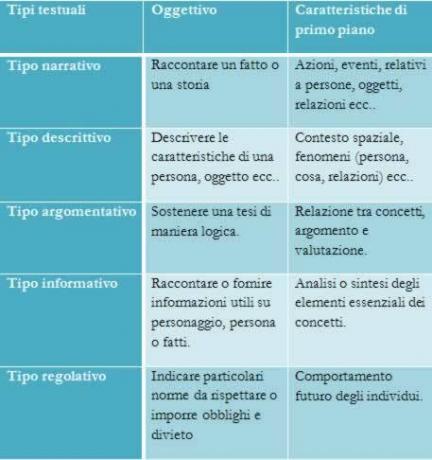
Ο νιτρικό αμμώνιο είναι μια στερεή ουσία του μοριακού τύπου NH4ΣΤΟ3 και λευκή εμφάνιση (όταν είναι καθαρή). συγκροτήθηκε από το ιόντα ΝΗ4+ (αμμώνιο) και ΟΧΙ3- (νιτρικό άλας), δεν είναι εύφλεκτο, αλλά είναι εξαιρετικά οξειδωτικό και αντιδραστικό. Η αντίδρασή του αποσύνθεσης δημιουργεί ως προϊόν μεγάλο όγκο αερίων, γεγονός που καθιστά την ακατάλληλη αποθήκευση αυτού του προϊόντος ένα σοβαρό πρόβλημα, καθώς ενδέχεται να προκληθούν εκρήξεις. Και επίσης χρησιμοποιείται ευρέως στη γεωργία ως λίπασμα.
Διαβάστε επίσης: Φυσικές ουσίες - μόρια που προέρχονται από τη φύση
Τι είναι το νιτρικό αμμώνιο;

Νιτρικό αμμώνιο είναι αλάτι αποτελείται από ιόντα NH4+ (αμμώνιο) και ΟΧΙ3- (νιτρικό άλας). Είναι μια στερεή ένωση που, όταν είναι καθαρό, έχει λευκό χρώμα. Χρησιμοποιείται ευρέως ως γεωργικό λίπασμα, αλλά μπορεί επίσης να χρησιμοποιηθεί στην κατασκευή εκρηκτικών, όπως είναι μια πολύ οξειδωτική ουσίακαι μετά οξειδωτικό. Η αντίδραση διαφυγής του νιτρικού αμμωνίου δημιουργεί υψηλή απελευθέρωση αέρια, προκαλώντας εκρηκτικές επιπτώσεις.
Χαρακτηριστικά του νιτρικού αμμωνίου
Μοριακή μάζα: 80.04336 g / mol.
Αλάτι αποτελούμενο από ιόντα: αμμώνιο (NH4+) και νιτρικά (NO3-).
Εμφάνιση: λευκό στερεό.
Είναι ισχυρή οξειδωτική.
Αντιδρά εύκολα με άλλες ουσίες.
Δεν είναι εύφλεκτο.
Για κανονικές συνθήκες θερμοκρασίας και πίεσης:
- πυκνότητα: 1,73 g / cm³;
- σημείο βρασμού: 210 ° C
- σημείο τήξεως: 169,6 ° C.
- βαθμός διαλυτότητας στο νερό: 216 g / 100 ml.
- pH: 5,5 (0,2M).
Φόρμουλα νιτρικού αμμωνίου
Ο μοριακός τύπος αυτής της ένωσης είναι ΝΗ4ΣΤΟ3.
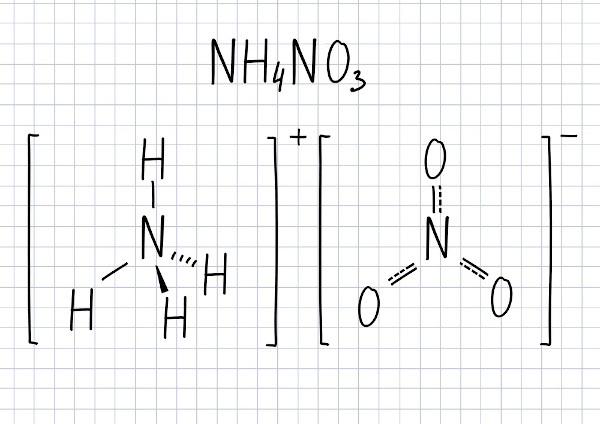
Αποσύνθεση νιτρικού αμμωνίου
για να είσαι ουσία με υψηλή αντιδραστικότητα και υψηλό οξειδωτικό δυναμικό, νιτρικό αμμώνιο, όταν υποβάλλεται σε υψηλή θερμοκρασία, προκαλεί α αντίδραση αποσύνθεσης, και τα κύρια προϊόντα είναι αέρια, άζωτο, οξυγόνο και υδρατμούς. Η αποσύνθεση δίνεται σε δύο στάδια:
→ 1ο βήμα:
2ΝΗ4ΣΤΟ3 (α) → 2Ν2O (g) + 4Η2Ο (ζ)
→ 2ο στάδιο:
2Ν2O → 2Ν2(ζ) + Ο2(σολ)
→ Παγκόσμια εξίσωση:
2ΝΗ4ΣΤΟ3 (α) → 2Ν2(ζ) + Ο2(g) + 4Η2Ο (ζ)
Παρατηρήστε ότι, στην πρώτη εξίσωση,ένα από τα προϊόντα που λαμβάνεται στην αποσύνθεση είναι το οξείδιο του αζώτου (Ν2Ο), επίσης γνωστός ως αέριο γέλιου. Χρησιμοποιείται για την αύξηση της ισχύος των κινητήρων αυτοκινήτων για την καύση καυσίμων και ως αναισθητικό, κυρίως από οδοντίατροι. Είναι επίσης ένα από τα κύρια αέρια που είναι υπεύθυνα για το φαινόμενο του θερμοκηπίου.
Δείτε επίσης: Ποιοι είναι οι τύποι χημικών αντιδράσεων;
Παραγωγή νιτρικού αμμωνίου
Το νιτρικό αμμώνιο μπορεί να ληφθεί από αντίδραση μεταξύ θειικού αμμωνίου (NH4)2ΜΟΝΟ4 και νιτρικό ασβέστιο Ca (ΟΧΙ3)2. Δες παρακάτω:
(ΝΗ4)2ΜΟΝΟ4 + Ca (ΟΧΙ3)2 → 2 ΝΗ4ΣΤΟ3+ Περίπτωση4
Μπορεί επίσης να παραχθεί από αέρια αμμωνία, το οποίο διοχετεύεται σε διάλυμα νιτρικού οξέος, έχοντας ως προϊόν αντίδρασης το υδατικό νιτρικό αμμώνιο. Κοίτα:
ΝΗ3 (ζ) + HNO3 (υδ) → ΝΗ4ΣΤΟ3(εδώ)
Χρήσεις νιτρικού αμμωνίου

- Κατασκευή λιπασμάτων
- Εκρηκτικά σε ορυχεία, λατομεία και κατασκευές
- Ζιζανιοκτόνα και εντομοκτόνα
- Λήψη οξειδίου του αζώτου για βιομηχανική εφαρμογή
- Απορροφητικά για οξείδια
- Οξειδωτικό για προωθητικά πυραύλων
- Κατασκευή ισοθερμικών σάκων
- Παραγωγή αναισθητικού καπνού για τη διαχείριση κυψελών στη μελισσοκομία
Επίσης πρόσβαση: Πώς να καταπολεμήσετε μια φωτιά;
Κίνδυνοι νιτρικού αμμωνίου
Ένας από τους κύριους κινδύνους που σχετίζονται με το νιτρικό αμμώνιο είναι το ανεπαρκής αποθήκευση. Καθώς είναι μια πολύ οξειδωτική ουσία και αντιδρά με πολλές άλλες ενώσεις, προκαλεί α αντίδραση με την απελευθέρωση μεγάλου όγκου αερίου. Η ακατάλληλη αποθήκευση υπόκειται σε μόλυνση με εύφλεκτα προϊόντα, έκθεση σε θερμότητα ή κατακράτηση αερίων, τι μπορεί να προκαλέσει εκρήξεις.
Αυτό έχει ήδη συμβεί στο Τέξας, στις Ηνωμένες Πολιτείες, για παράδειγμα, με φορτηγό πλοίο που ήρθε από τη Γαλλία και μετέφερε 2.086 τόνους νιτρικού αμμωνίου. το ατύχημα συνέβη το 1947 και έγινε γνωστό ως καταστροφή της πόλης του Τέξας. Η τραγωδία προκάλεσε το θάνατο 581 ανθρώπων και συνέβη λόγω πυρκαγιάς που δεν περιείχε το πλοίο που έφτασε στο φορτίο αμμωνίου, προκαλώντας την έκρηξη.
Ένα άλλο παράδειγμα ήταν το ακολουθία έκρηξης που συνέβη στις 4 Αυγούστου 2020 στο λιμάνι του πόλη της Βηρυτού, Λίβανος, αφήνοντας περισσότερους από 100 ανθρώπους νεκρούς και 5.000 τραυματίες. Το μέγεθος της έκρηξης προκλήθηκε από την ανάφλεξη μιας αλυσιδωτής αντίδρασης του φορτίου 2.750 τόνων νιτρικού αμμωνίου που αποθηκεύτηκαν εκεί.
Αξίζει επίσης να σημειωθεί ότι μπορεί να προκαλέσει νιτρικό αμμώνιο ερεθισμός του δέρματος και των ματιών και, εάν εισπνέεται, αναπνευστικά προβλήματα. Στην κυκλοφορία του αίματος, η ουσία έχει τοξική ισχύ, καθώς αντιδρά με σωματικά υγρά και τα προϊόντα αυτής της αντίδρασης, όπως το νιτρικό άλας, μπορούν να προκαλέσουν βλάβη στην υγεία, όπως μπλε ασθένεια μωρού, επίσης γνωστή ως παιδική μεθαιμοσφαιριναιμία (αιμοσφαιρίνη χαμηλού αίματος) Αυτή η ασθένεια επαναλαμβάνεται σε οικογένειες σε αγροτικές περιοχές λόγω μόλυνσης με νιτρικό αμμώνιο, που υπάρχει στα λιπάσματα, υδάτινων σωμάτων στην περιοχή καλλιέργειας.
από τη Laysa Bernardes
Καθηγητής Χημείας
Πηγή: Σχολείο της Βραζιλίας - https://brasilescola.uol.com.br/quimica/nitrato-de-amonio.htm