Φανταστείτε ότι προσθέτετε 10 g επιτραπέζιου αλατιού (χλωριούχο νάτριο - NaCl) σε ένα ποτήρι με 100 g νερού στους 20ºC. Μετά την ανάμιξη, βλέπετε ότι το αλάτι έχει διαλυθεί εντελώς, οπότε αποφασίζετε να προσθέσετε ακόμη περισσότερο αλάτι. Σε κάποιο σημείο, δεν θα μπορείτε πλέον να διαλύσετε το αλάτι σε αυτήν την ποσότητα νερού και οποιοδήποτε πρόσθετο αλάτι θα βυθιστεί στο κάτω μέρος του ποτηριού, ανεξάρτητα από το πόσο σκληρά προσπαθείτε να το αναμίξετε.
Όταν συμβεί αυτό, λέμε ότι η λύση είναι κορεσμένο και ότι το συντελεστής διαλυτότητας. Επομένως, μπορούμε να ορίσουμε τον συντελεστή διαλυτότητας ως εξής:
“Ο συντελεστής διαλυτότητας είναι η μέγιστη ποσότητα διαλυμένης ουσίας που διαλυτοποιείται σε δεδομένη ποσότητα διαλύτη, σε δεδομένη θερμοκρασία. "
Ο συντελεστής διαλυτότητας του αλατιού στο νερό, για παράδειγμα, είναι ίσος με 36 g NaCl / 100 g νερού στους 20ºC. Δεν είναι δυνατόν να διαλυθεί ένα επιπλέον γραμμάριο αλατιού σε αυτήν την ποσότητα νερού και σε αυτήν τη θερμοκρασία, όπως ο συντελεστής διαλυτότητας είναι ειδικός για κάθε ουσία.
Αν αλλάξουμε τη διαλυμένη ουσία, για παράδειγμα, αντικαθιστώντας το επιτραπέζιο αλάτι με NH4Cl, αυτό έχει συντελεστή διαλυτότητας ίσο με 37,2 g σε 100 g νερού στους 20 ° C.Επί πλέον, η ίδια ουσία έχει διαφορετικές διαλυτότητες σε διαφορετικούς διαλύτες. Ενώ το άλας είναι διαλυτό στο νερό, είναι πρακτικά αδιάλυτο σε ακετόνη ή οξικό αιθυλεστέρα (διαλύτης που χρησιμοποιείται για την απομάκρυνση των υαλοπινάκων).
Ένα άλλο σημείο είναι ότι όταν αναφέρεται ο συντελεστής διαλυτότητας μιας διαλυμένης ουσίας σε μια δεδομένη ποσότητα διαλύτη, είναι επίσης απαραίτητο να αναφερθεί η θερμοκρασία, καθώς αυτός είναι ένας παράγοντας παρεμβολής. Για παράδειγμα, εάν πάρουμε 100 g νερού στους 20 ° C και προσθέσουμε 40 g αλατιού, 36 g θα διαλυτοποιηθούν και 4 g θα σχηματίσουν το ίζημα. Αλλά αν πάρουμε αυτήν τη λύση στη θέρμανση, θα δούμε ότι τα 4 g θα διαλυθούν καθώς η θερμοκρασία αυξάνεται.
Αυτό μας δείχνει ότι η ίδια διαλυμένη ουσία διαλυμένη στην ίδια ποσότητα διαλύτη έχει διαφορετικούς συντελεστές διαλυτότητας καθώς αυξάνεται η θερμοκρασία.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)
Δείτε ένα παράδειγμα παρακάτω:
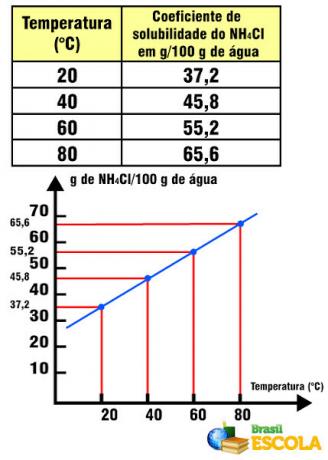
Συντελεστής διαλυτότητας NH4Cl σε σχέση με τη θερμοκρασία
Σημειώστε ότι σε αυτήν την περίπτωση, ο συντελεστής διαλυτότητας του NH4Το Cl αυξάνεται με την αύξηση της θερμοκρασίας. Αυτό συμβαίνει με τα περισσότερα άλατα στο νερό. Ωστόσο, υπάρχουν περιπτώσεις στις οποίες ο συντελεστής διαλυτότητας μειώνεται με την αύξηση της θερμοκρασίας, όπως στην περίπτωση του Ce2(ΜΟΝΟ4)3. Υπάρχουν επίσης περιπτώσεις στις οποίες δεν υπάρχει τόσο σημαντική μεταβλητότητα στον συντελεστή διαλυτότητας, όπως συμβαίνει με το επιτραπέζιο αλάτι. Δείτε το στο κείμενο Γραφήματα καμπυλών διαλυτότητας.
Ίσως μπορούμε επίσης, σε ορισμένες συγκεκριμένες καταστάσεις, να διαλύσουμε μια ποσότητα διαλυμένης ουσίας στο διαλύτη μεγαλύτερη από τον συντελεστή διαλυτότητάς μας, λαμβάνοντας έτσι το λεγόμενο υπερκορεσμένο διάλυμα. Για παράδειγμα, φανταστείτε ότι ένα διάλυμα σχηματίστηκε με 100 g νερού, στους 20 ° C, και 40 g επιτραπέζιου αλατιού (με 36 g διαλυμένο και καταβύθιση 4 g), θερμαίνεται μέχρι να φτάσει σε θερμοκρασία στην οποία όλη η διαλυμένη ουσία διαλυτοποιήστε τον εαυτό σας. Στη συνέχεια, αυτή η λύση αφήνεται να ηρεμήσει έτσι ώστε να κρυώσει μέχρι να φτάσει σε θερμοκρασία δωματίου, η οποία είναι κοντά στους 20ºC.
Εάν δεν υπάρχει διαταραχή στο διάλυμα, η επιπλέον διαλυμένη ουσία θα παραμείνει διαλυμένη, αποτελώντας έτσι ένα κορεσμένο διάλυμα. Ωστόσο, αυτός ο τύπος διαλύματος είναι πολύ ασταθής και οποιαδήποτε ξαφνική κίνηση μπορεί να προκαλέσει την κρυστάλλωση της ποσότητας πάνω από τον συντελεστή διαλυτότητας για τη θερμοκρασία αυτή. Έτσι, η λύση που ήταν υπερκορεσμένο θα γίνει κορεσμένο με φόντο του σώματος.
Μια τελευταία περίπτωση είναι η ακόρεστο διάλυμα, δηλαδή όταν η ποσότητα διαλυμένης διαλυμένης ουσίας είναι μικρότερη από την τιμή του συντελεστή διαλυτότητας. Ένα παράδειγμα είναι η διάλυση 10 g NaCl σε 100 g νερού στους 20 ° C.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Συντελεστής διαλυτότητας" · Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/coeficiente-solubilidade.htm. Πρόσβαση στις 28 Ιουνίου 2021.



