Οι καταλύτες είναι ουσίες ικανές να επιταχύνουν μια αντίδραση χωρίς να αλλοιωθούν, δηλαδή δεν καταναλώνονται κατά τη διάρκεια της αντίδρασης.
Για να καταλάβουμε πώς λειτουργούν οι καταλύτες, πρέπει να θυμόμαστε τι εξηγήθηκε στο κείμενο "Ενέργεια ενεργοποίησης”. Όπως φαίνεται εκεί, για να ξεκινήσει μια χημική αντίδραση, είναι απαραίτητο τα αντιδραστήρια να έχουν ή να λαμβάνουν μια ορισμένη ποσότητα ελάχιστης ενέργειας, η οποία ονομάζεται ενέργεια ενεργοποίησης.
Με αυτήν την ελάχιστη ενέργεια, τα αντιδρώντα μπορούν να φτάσουν στο ενεργοποιήθηκε το σύμπλεγμα, η οποία είναι μια ενδιάμεση κατάσταση (κατάσταση μετάβασης) που σχηματίζεται μεταξύ αντιδρώντων και προϊόντων, στην οποία δομή υπάρχουν οι αποδυναμωμένοι προηγούμενοι σύνδεσμοι και ο σχηματισμός νέων συνδέσμων (υπάρχουν στο προϊόντα).
Για παράδειγμα, εξετάστε τη γενική αντίδραση παρακάτω:
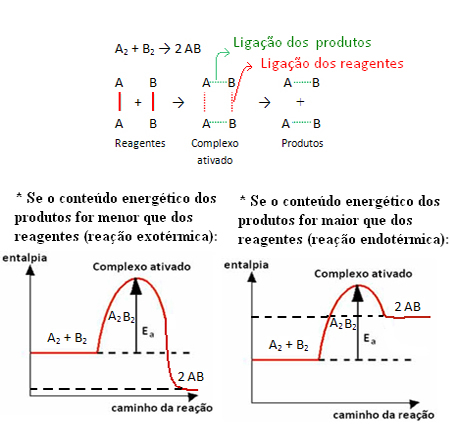
Σημειώστε ότι η ενέργεια ενεργοποίησης που απαιτείται για την επίτευξη του ενεργοποιημένου συμπλόκου γίνεται ένα είδος εμποδίου που πρέπει να ξεπεραστεί για να λάβει χώρα η αντίδραση. Αυτό σημαίνει ότι όσο μεγαλύτερη είναι η ενέργεια ενεργοποίησης μιας αντίδρασης, τόσο μεγαλύτερο είναι το εμπόδιο που πρέπει να ξεπεραστεί και τόσο μικρότερη είναι η ταχύτητα της αντίδρασης.
Το αντίθετο ισχύει επίσης, εάν η ενέργεια ενεργοποίησης είναι χαμηλότερη, η αντίδραση θα είναι ταχύτερη. Αυτό ακριβώς είναι οι καταλύτες μήπως δημιουργούν μια εναλλακτική διαδρομή, η οποία απαιτεί λιγότερη ενέργεια ενεργοποίησης, κάνοντας την αντίδραση να προχωρήσει γρηγορότερα.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση.)

Προκειμένου να μειωθεί η ενέργεια ενεργοποίησης, ο καταλύτης δρα αλλάζοντας τον μηχανισμό αντίδρασης, συνδυάζοντας με τα αντιδραστήρια σε ένα σύστημα που μπορεί να είναι μονοφασικό (ομογενής κατάλυση) ή πολυφασικό (ετερογενής κατάλυση).
Περισσότερες λεπτομέρειες σχετικά με αυτούς τους τύπους κατάλυσης μπορείτε να δείτε στα παρακάτω κείμενα:
- ομοιογενής κατάλυση
- ετερογενής κατάλυση
Αλλά, γενικά, μπορούμε να το πούμε αυτό Ο συνδυασμός του αντιδραστηρίου και του καταλύτη σχηματίζει μια ενδιάμεση ένωση που μετά μεταμορφώνεται, δημιουργώντας το προϊόν και τον καταλύτη. Σημειώστε πώς μπορεί να αναπαρασταθεί:
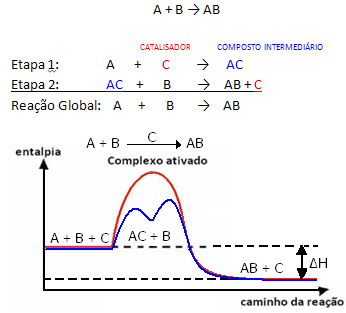
Δείτε ότι ο καταλύτης αναγεννάται στο τέλος της αντίδρασης, χωρίς να καταναλώνεται από αυτόν.
Ένα σημαντικό γεγονός είναι αυτό ο καταλύτης επιταχύνει τόσο τις εμπρός όσο και τις αντίστροφες αντιδράσεις, αυτό σημαίνει ότι μειώνει την ενέργεια ενεργοποίησης και των δύο.
Από την Jennifer Fogaça
Αποφοίτησε στη Χημεία
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
FOGAÇA, Jennifer Rocha Vargas. "Πώς δρα οι καταλυτικές ουσίες;" Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Πρόσβαση στις 27 Ιουνίου 2021.
