Ένα μόριο είναι μια ομάδα ατόμων του ίδιου ή διαφορετικού στοιχείου. Δείτε μερικά παραδείγματα:
Η2Ο - μόριο που σχηματίζεται από δύο διαφορετικά στοιχεία (δύο άτομα υδρογόνου και ένα άτομο οξυγόνου) ·
Κλ2- μόριο που σχηματίζεται από ένα μόνο χημικό στοιχείο (δύο άτομα χλωρίου).
Στο μόρια μπορεί να ταξινομηθεί σε πολικός ή απολόος:
μη πολικό: μόρια που δεν έχουν πόλους (θετικά και αρνητικά).
πολικός: μόρια που έχουν πόλους (θετικά και αρνητικά).
Σε αυτό το κείμενο, θα τονίσουμε το πολικά μόρια. Για να προσδιορίσετε ένα πολικό μόριο, μπορούμε να χρησιμοποιήσουμε μία από τις προτεινόμενες στρατηγικές παρακάτω:
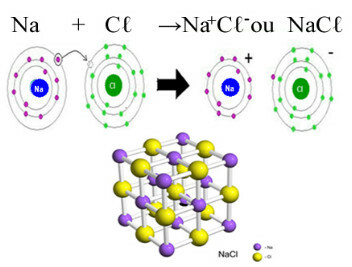
Ο) ιοντική ένωση (σχηματίζεται από ιοντικό δεσμό)
Εάν η ουσία προέρχεται από ιοντικός δεσμός (μεταξύ ενός μετάλλου και ενός μη μετάλλου), σημαίνει ότι σχηματίζεται από ιόντα (κατιόν και ανιόν). Επομένως, αυτή η ουσία εμφανίζεται αυτόματα πολικά μόρια, αφού τα ιόντα έχουν θετικά και αρνητικά φορτία.
Παραδείγματα:
NaCl (Το Na είναι μέταλλο και το Cl είναι μη μέταλλο).
CaO (το Ca είναι μέταλλο και το O είναι μη μέταλλο).
MgS (το Mg είναι μέταλλο και το S είναι μη μέταλλο).
ΣΙ) Μοριακές ενώσεις (σχηματίζεται από ομοιοπολικό δεσμό)
Όταν η ένωση είναι μοριακή, πρέπει να αναλύσουμε κάθε περίπτωση, καθώς έχουμε τη δυνατότητα πολλών διαφορετικών μορίων. Τα παρακάτω είναι μερικά παραδείγματα και κανόνες που μπορούν να βοηθήσουν στον προσδιορισμό των πολικών μοριακών ενώσεων:
- Διατομικό μόριο με διαφορετικά στοιχεία
Εάν η μοριακή ένωση αποτελείται από μόλις δύο άτομα και αυτά τα δύο άτομα προέρχονται από διαφορετικά στοιχεία, αυτόματα το μόριο θα είναι πολικό, διότι τα δύο άτομα έχουν διαφορετικές ηλεκτροonegativities. Παραδείγματα: HBr και NO.
- Μόρια με δύο ή περισσότερα άτομα (ίδιο ή διαφορετικό)
Σε μόρια που έχουν αριθμό ατόμων μεγαλύτερο από δύο, πρέπει να λάβουμε υπόψη την ποσότητα των νεφών συνδετικά και μη συνδετικά που υπάρχουν στο κεντρικό άτομο του μορίου και το συγκρίνουν με τον αριθμό ίσων ατόμων που συνδέονται με το άτομο κεντρικός. Τα δεσμευτικά σύννεφα είναι απλοί δεσμοί (ένα ηλεκτρόνιο από το κέλυφος σθένους κάθε ατόμου που εμπλέκεται), διπλοί δεσμοί (δύο ηλεκτρόνια από το κέλυφος σθένους κάθε ατόμου που εμπλέκεται) ή τριπλάσια (τρία ηλεκτρόνια από το κέλυφος σθένους κάθε ατόμου εμπλεγμένος). Τα μη δεσμευτικά σύννεφα είναι τα ζεύγη ηλεκτρονίων στο κέλυφος σθένους που δεν συμμετέχουν στους δεσμούς.
Μην σταματάς τώρα... Υπάρχουν περισσότερα μετά τη διαφήμιση;)
Παρατήρηση: Για να μάθετε τον αριθμό των ηλεκτρονίων στο κέλυφος σθένους ενός δεδομένου ατόμου, απλώς μάθετε την περιοδική οικογένεια του:

Για να προσδιορίσετε εάν το μόριο είναι πολικό, αρκεί να ελέγξετε αν ο αριθμός των νεφών που υπάρχουν στο κεντρικό άτομο είναι διαφορετικός από τον αριθμό των ίσων ατόμων που συνδέονται με αυτό. Δείτε μερικά παραδείγματα:
HCN
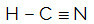
Το κεντρικό άτομο του μορίου είναι άνθρακας και έχει δύο διαφορετικά συνδετικά,δύο δεσμευτικά σύννεφα (μονό και τριπλό) και δεν υπάρχει ζεύγος μη συνδεδεμένων ηλεκτρονίων (προέρχεται από την οικογένεια VIA, έχει τέσσερα ηλεκτρόνια στο κέλυφος σθένους και χρησιμοποιεί και τα τέσσερα, ένα στον μονό δεσμό και τρία στο τριπλό). Για το λόγο αυτό, σχηματίζει ένα πολικό μόριο.
εν συντομία:
ΝΗ3
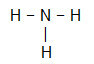
Το κεντρικό άτομο του μορίου είναι άζωτο και έχει τρεις ίσους συνδέτες και ένα σύνολο τέσσερα σύννεφα, που είναι τρία δεσμευτικά σύννεφα (τρεις μονό δεσμοί) και ένα που δεν συνδέεται (προέρχεται από την οικογένεια VA, έχει πέντε ηλεκτρόνια) στο στρώμα σθένους και χρησιμοποιεί μόνο τρία, ένα σε κάθε σύνδεση, αφήνοντας δύο όχι συνδετικά).
Εξαιτίας αυτού, το κεντρικό άτομο του NH3 σχηματίζει ένα πολικό μόριο.
Εν συντομία:

Χ.Χ.2Ο
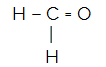
Το κεντρικό άτομο του μορίου είναι άνθρακας και έχει δύο πανομοιότυπα και ένα διαφορετικά προσδέματα, καθώς καιτρία δεσμευτικά σύννεφα (δύο μονό και ένας διπλοί δεσμοί), χωρίς ζεύγος ηλεκτρονίων που δεν συνδέονται (προέρχεται από την οικογένεια VIA, έχει τέσσερα ηλεκτρόνια στο κέλυφος σθένους και χρησιμοποιεί τα 4, δύο στο μονό και δύο στο ζεύγος). Εξαιτίας αυτού, σχηματίζει ένα πολικό μόριο.
εν συντομία:
Από μένα. Diogo Lopes Dias
Θα θέλατε να αναφέρετε αυτό το κείμενο σε σχολείο ή ακαδημαϊκό έργο; Κοίτα:
DAYS, Diogo Lopes. "Πολικά μόρια"; Σχολείο της Βραζιλίας. Διαθέσιμο σε: https://brasilescola.uol.com.br/quimica/moleculas-polares.htm. Πρόσβαση στις 28 Ιουνίου 2021.
Ιονικές ενώσεις, κύρια χαρακτηριστικά των ιοντικών ενώσεων, σύνδεση μεταξύ ιόντων, οριστική μεταφορά ηλεκτρονίων, ηλεκτροστατικές δυνάμεις έλξης μεταξύ ιόντων, αρνητικών και θετικών ιόντων, ανιόντων, κατιόντων, ιοντικής σύνδεσης, μοριακή δομή αυτός
Χημεία
Μοριακές ουσίες, θερμοκρασία βρασμού, επιφάνεια επαφής, σημείο βρασμού, διαμοριακές δυνάμεις έλξης, χημικός δεσμός, μοριακές ενώσεις, ομοιοπολικοί χημικοί δεσμοί, ιοντικοί δεσμοί, μεταλλικοί δεσμοί, φυσικές καταστάσεις κακό