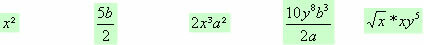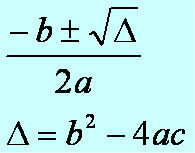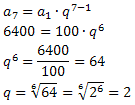wenn wir reagieren Acid (HX) und a Base (MeOH) gibt es eine chemische Reaktion namens Neutralisation, die von a. stammt Salz- anorganisch und ein Wassermolekül. Bei dieser Reaktion reagiert der ionisierbare Wasserstoff (in der Säure vorhanden) mit dem Hydroxyl (in der Base vorhanden) zu Wasser:
H+ + OH- → H2Ö
Die Gleichung, die das Phänomen der Neutralisation darstellt, kann wie folgt ausgedrückt werden:
HX + MeOH → MeX + H2Ö
Wenn nur ein Teil der ionisierbaren Wasserstoffe in der Säure mit den Hydroxylen in der Base reagiert oder umgekehrt, wird die Reaktion als partielle Neutralisation bezeichnet.
In den Gleichungen, die eine teilweise Neutralisation darstellen, gibt es das Vorhandensein von Salzen mit Wasserstoff (H) und Hydroxyl (OH). Siehe unten für das allgemeine Format einer partiellen Neutralisationsgleichung:
Teilneutralisationsgleichung mit Überschuss an Hydroxylen:
HX + Me (OH)2 → MeOHX + H2Ö
Teilneutralisationsgleichung mit Überschuss an ionisierbaren Wasserstoffen:
H2X + MeOH → MeHX + H2Ö
Wenn wir die allgemeinen Gleichungen der partiellen Neutralisation analysieren, können wir sehen, dass wir bei jeder Reaktion dieser Art ein hydriertes Salz (MeHX) oder ein hydroxyliertes Salz (MeOHX) bilden. Die Bildung eines der beiden Salze hängt von der Beziehung zwischen der Menge an Hydroxylen in der Base und ionisierbaren Wasserstoffen in der Säure ab.
einige sehen Beispiele für partielle Neutralisationsgleichungen:
Beispiel 1: Teilneutralisationsgleichung zwischen Salzsäure (HCl) und Magnesiumhydroxid [Mg (OH)2]:
1 HCl + 1 mg (OH)2 → MgOHCl + 1 H2Ö
Bei der Analyse der partiellen Neutralisationsgleichung zwischen der fraglichen Säure und der betreffenden Base müssen wir:
Die Säure hat nur einen ionisierbaren Wasserstoff;
Die Base hat zwei Hydroxylgruppen;
nur ein Hydroxyl es wird bei der Bildung von Wasser verwendet, da es nur einen ionisierbaren Wasserstoff gibt;
Das nicht verwendete Hydroxyl bei der Wasserbildung ist es Teil des gebildeten Salzes und wird in der Formel des Salzes nach dem Metall und vor dem Cl-Anion geschrieben.
Beispiel 2: Teilneutralisationsgleichung zwischen Phosphorsäure (H3STAUB4) und Kaliumhydroxid (KOH).
1 Stunde3STAUB4 + 1 KOH → KH2STAUB4 + 1 Stunde2Ö
Bei der Analyse der partiellen Neutralisationsgleichung zwischen der fraglichen Säure und der betreffenden Base müssen wir:
Die Säure hat drei ionisierbare Wasserstoffatome;
Die Base hat ein Hydroxyl;
Einziger ionisierbarer Wasserstoff es wird bei der Bildung von Wasser verwendet, da die Base nur ein Hydroxyl enthält;
Sie zwei ionisierbare Wasserstoffe die nicht bei der Wasserbildung verwendet werden, sind Teil des gebildeten Salzes und werden in der Salzformel nach dem Metall und vor dem PO-Anion geschrieben4.
Beispiel 3: Teilneutralisationsgleichung zwischen Schwefelsäure (H2NUR4) und Titanhydroxid IV [Ti(OH)4].
1 Stunde2NUR4 + 1 Ti (OH)4 → Ti(OH)2NUR4 + 2 H2Ö
Bei der Analyse der partiellen Neutralisationsgleichung zwischen der fraglichen Säure und der betreffenden Base müssen wir:
Die Säure hat nur einen ionisierbaren Wasserstoff;
Die Base hat zwei Hydroxylgruppen;
Nur zwei Hydroxyle sie werden bei der Bildung von Wasser verwendet, weil es nur zwei ionisierbare Wasserstoffatome gibt;
Die nicht verwendeten Hydroxyle bei der Wasserbildung sind sie Teil des gebildeten Salzes und werden in der Formel des Salzes nach dem Metall und vor dem Anion SO. geschrieben4.
Beispiel 4: Teilneutralisationsgleichung zwischen Pyrophosphorsäure (H4P2Ö7) und Silberhydroxid (AgOH).
1 Stunde4P2Ö7 + 1 AgOH → AgH3P2Ö7 + 1 Stunde2Ö
Die Säure hat vier ionisierbare Wasserstoffatome;
Die Base hat ein Hydroxyl;
Einziger ionisierbarer Wasserstoff es wird bei der Bildung von Wasser verwendet, da die Base nur ein Hydroxyl enthält;
Sie drei ionisierbare Wasserstoffe die nicht bei der Wasserbildung verwendet werden, sind Teil des gebildeten Salzes und werden in der Salzformel nach dem Metall und vor dem P-Anion geschrieben2Ö7.
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/equacoes-neutralizacao-parcial.htm